[解析]
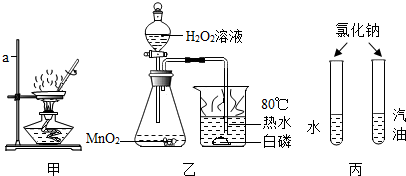
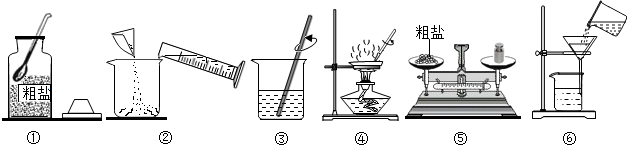
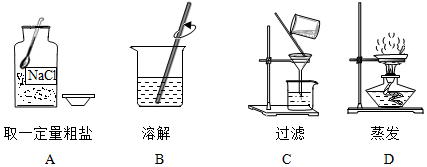
解:步骤一:粗盐提纯
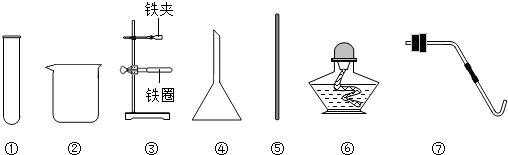
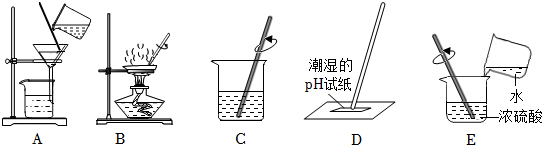
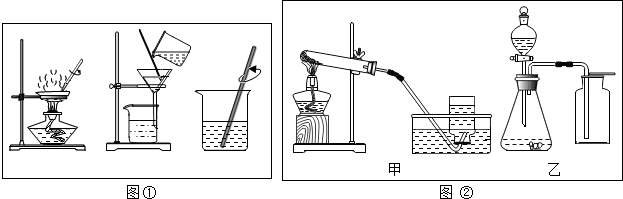
(1)溶解需要用到烧杯和玻璃棒;
(2)过滤操作中上图缺少的关键仪器是漏斗;
(3)蒸发结晶:将滤液倒入蒸发皿中加热,当出现较多晶体时可以停止连续加热;
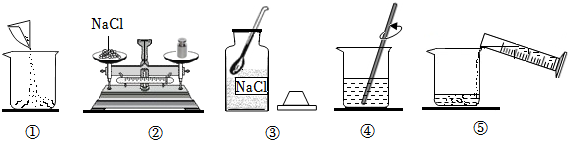
步骤二:配制溶液
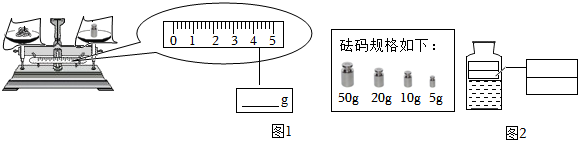
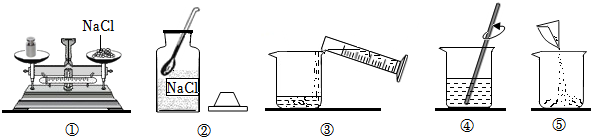
(1)需要氯化钠质量=20g×10%=2g,需要水的质量=20g﹣2g=18g,所以水的体积18mL;
(3)溶解:溶解时在烧杯中先加入氯化钠再加入水.充分溶解后得到的溶液为氯化钠溶液,其中所含的微粒有水分子、钠离子、氯离子;
实验反思:
配制的溶液经测定溶质质量分数小于10%,可能是提纯后所得的粗盐不纯净,仍然含有可溶性的杂质,量取水时仰视读数,造成水的量增大,溶质质量分数偏小;而溶液配制好后装入试剂瓶时有部分洒到桌面上,对溶质质量分数无影响,称取固体时最终天平指针偏左则固体称多,会使得溶质质量分数偏大.
故答案为:步骤一:粗盐提纯
(1)AE;(2)漏斗;(3)出现较多晶体;
步骤二:配制溶液
(1)18;(3)H2O、Na+、Cl﹣;
实验反思:AB.

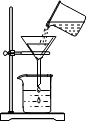 将含有少量泥沙的食盐提纯并配制食盐水溶液,某同学进行以下实验操作,回答下列问题.
将含有少量泥沙的食盐提纯并配制食盐水溶液,某同学进行以下实验操作,回答下列问题.