服务热线
搜题▪组卷

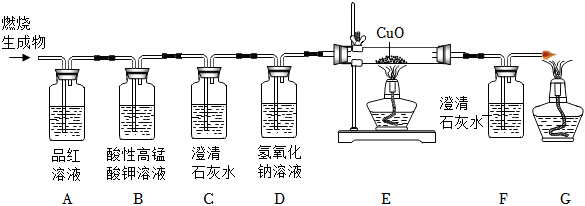
| 实验操作 | 实验现象 | 实验结论 |
| 甲同学用排水法收集A、B两瓶气体。将带火星的木条伸入A瓶中,将湿润的淀粉碘化钾试纸伸入B瓶中 | A瓶中带火星的木条复燃。B瓶中湿润的淀粉碘化钾试纸不变色 | 猜想 成立 |
| 乙再学用向上排空气法收集A、B两瓶气体,将带火星的木条伸入A瓶中,将湿润的淀粉碘化钾试纸伸入B瓶中 | A瓶中的现象是带火星的木条复燃,B瓶中的现象是 | 猜想三成立 |
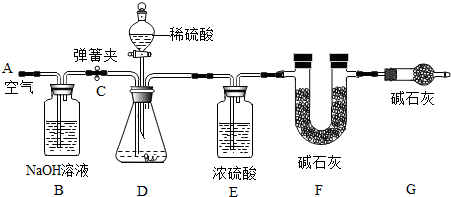
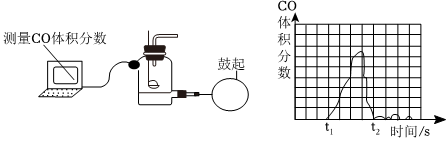
| 方案 |
|
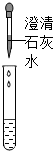
|
| 现象 | 溶液变红 | 产生 |
| 结论 | 溶液中有氢氧化钠 | 溶液中有碳酸钠 |
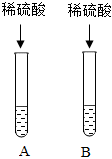 实验课上,同学们以“鉴别氢氧化钠、碳酸钠、稀硫酸、氯化钠”为题展开实验,并探究其反应后混合液的成分。
实验课上,同学们以“鉴别氢氧化钠、碳酸钠、稀硫酸、氯化钠”为题展开实验,并探究其反应后混合液的成分。| 实验步骤 | 实验现象 | 实验结论 | |
| 方案一 | 取少量反应后的液体于试管中,加入适量BaCl2溶液 | 有白色沉淀产生 | 试管A中已发生化学反应 |
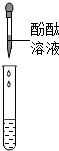
| 方案二 | 取少量反应后的液体于试管中,加入几滴酚酞溶液 | 溶液为无色 |
| 实验步骤 | 实验现象 | 实验结论 | |
| 活动— | 取少量烧杯中的溶液于试管中加入足量Ba(NO3)2,再加入少量稀硝酸 | 有白色沉淀产生,加入稀硝酸后, | 溶液中含有Na2CO3,猜想②成立 |
| 活动二 | 取少量烧杯中的溶液于试管中加入稀盐酸 | 有气泡生成 | 溶液中含有Na2CO3,猜想②成立 |
| 活动三 | 加入少量 | 无明显现象 | 溶液中不含H2SO4想④不成立 |
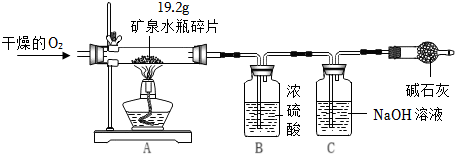
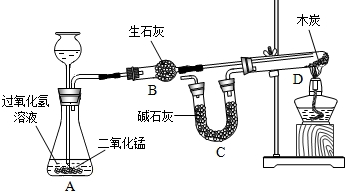
| 过氧化氢的浓度 | 过氧化氢溶液质量(g) | 二氧化锰质量(g) | 收集时间(s) | |
| 1 | 10% | 20 | 1 | 40 |
| 2 | 15% | 20 | 1 | 20 |
| 3 | 20% | x | 1 | 12 |
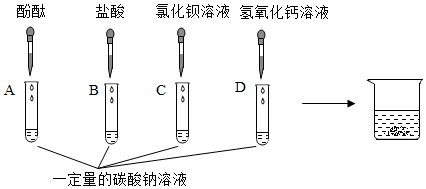
| 实验操作 | 实验现象 | 实验结论 |
| 取大烧杯中上层溶液少许于一支试管中,滴加过量的BaCl2溶液,静置 | ③ ; 试管中的上层溶液仍是红色 |
大烧杯中上层溶液中一定含有CO32-, 发生的化学反应方程式为 ④ ; 同时还能得出大烧杯中的上层溶液中一定含有阴离子是⑤ (填离子符号) |
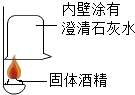
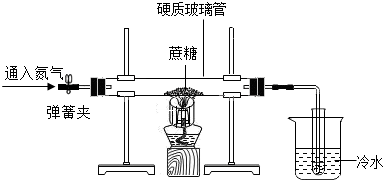
 同学们在学习“化学反应中的能量变化”时,进行了如下探究实验。
同学们在学习“化学反应中的能量变化”时,进行了如下探究实验。| 同学 | 实验方案 | 预测实验现象 | 结论 |
| 甲 | 向试管中滴加Na2CO3溶液 | 产生白色沉淀 | 猜想一成立 |
| 乙 | 向试管中通入CO2气体 | 产生白色沉淀 | 猜想二成立 |
| 丙 | 向试管中滴加NaOH溶液 | 产生白色沉淀 | 猜想三成立 |
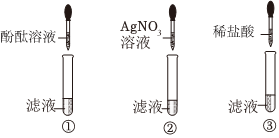
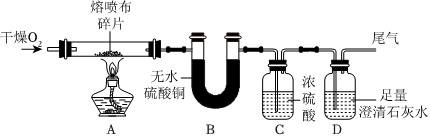
| 实验操作 | 实验现象 | 实验分析与结论 |
| 取打磨后的“锡纸”片放入试管中,滴加氯化锌溶液 | “锡纸”表面有深灰色固体析出 | 根据实验现象,结合金属活动性顺序可知猜想 (填“Ⅰ”或“Ⅱ”)成立;反应的化学方程式为 。 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,加入足量的 | 有气泡产生 | 猜想C正确 |

hu@dyw.com
2022-11-20
初中化学 | 九年级上 | 实验题