[考点]
实验探究物质的组成成分以及含量,盐的化学性质,
[答案]
(1)氯化钠;
(2)Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
(3)若A中没有发生反应,硫酸也能与氯化钡反应生成硫酸钡沉淀;
(4)混合过程中有气泡产生,则说明混合前试管A中H2SO4过量,NaOH已反应完全,混合过程中也没有NaOH生成,故溶质中一定不含NaOH;
进行实验:活动一:沉淀部分溶解,并有气泡产生;
活动三:碳酸钠(合理即可)。
[解析]
解:(1)氢氧化钠、碳酸钠溶液呈碱性,能使紫色石蕊试液变蓝,硫酸呈酸性,能使紫色石蕊试液变红,氯化钠呈中性,不能使紫色石蕊试液变色,故答案为:氯化钠;
(2)试管B中碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,反应的化学方程式为Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,故答案为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
(3)硫酸与氯化钡反应也会生成硫酸钡沉淀,所以即使没有反应也会生成硫酸钡沉淀,故答案为:若A中没有发生反应,硫酸也能与氯化钡反应生成硫酸钡沉淀;
(4)混合过程中观察到有气泡产生,说明试管A中有硫酸剩余,NaOH已反应完全,试管B中有碳酸钠剩余,混合过程中也没有NaOH生成,故溶质中一定不含NaOH,所以猜想③不成立,故答案为:混合过程中有气泡产生,则说明混合前试管A中H2SO4过量,NaOH已反应完全,混合过程中也没有NaOH生成,故溶质中一定不含NaOH;
进行实验:活动一:溶液中一定含有碳酸钠,碳酸钡沉淀与硝酸反应生成硝酸钡、水和二氧化碳,硫酸钡沉淀不溶于稀硝酸,所以向溶液中加入稀硝酸后,会观察到沉淀部分溶解,并有气泡产生;故答案为:沉淀部分溶解,并有气泡产生;
活动三:若要鉴别是否含有H2SO4,则可向反应后的溶液中加入适量的锌粉等活动性较强的金属粉末或氧化铜粉末或碳酸钠溶液等,未观察到明显现象时,证明溶液中不含H2SO4,故答案为:碳酸钠(合理即可)。
[点评]
本题考查了"实验探究物质的组成成分以及含量,盐的化学性质,",属于"易错题",熟悉题型是解题的关键。
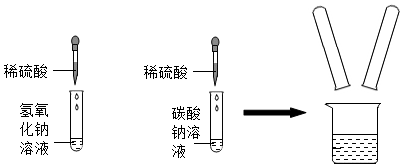
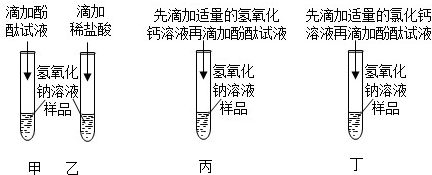
 实验课上,同学们以“鉴别氢氧化钠、碳酸钠、稀硫酸、氯化钠”为题展开实验,并探究其反应后混合液的成分。
实验课上,同学们以“鉴别氢氧化钠、碳酸钠、稀硫酸、氯化钠”为题展开实验,并探究其反应后混合液的成分。 同学们在学习“化学反应中的能量变化”时,进行了如下探究实验。
同学们在学习“化学反应中的能量变化”时,进行了如下探究实验。
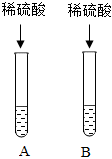
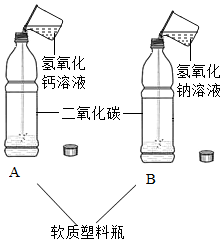 实验室在做有关CO2的性质实验中,用氢氧化钠溶液吸收CO2,而不用澄清石灰水,小喵同学想用以下A、B两组对比试验进行验证(实验后立即盖紧瓶盖并振荡);
实验室在做有关CO2的性质实验中,用氢氧化钠溶液吸收CO2,而不用澄清石灰水,小喵同学想用以下A、B两组对比试验进行验证(实验后立即盖紧瓶盖并振荡);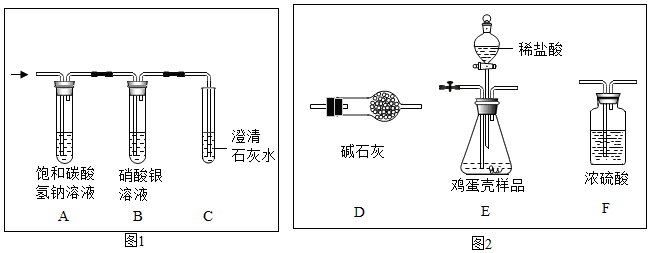
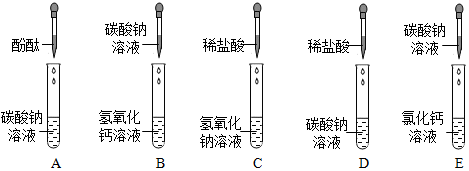
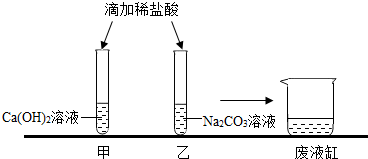 实验结束,甲、乙同学依次将废液缓慢倒入同一洁净的废液缸中,然后进行了讨论。
实验结束,甲、乙同学依次将废液缓慢倒入同一洁净的废液缸中,然后进行了讨论。