服务热线
搜题▪组卷
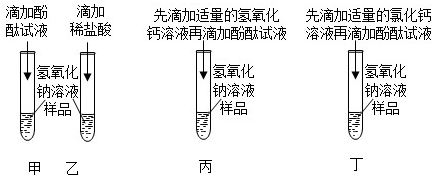
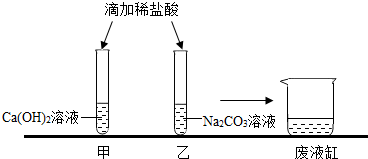 实验结束,甲、乙同学依次将废液缓慢倒入同一洁净的废液缸中,然后进行了讨论。
实验结束,甲、乙同学依次将废液缓慢倒入同一洁净的废液缸中,然后进行了讨论。
 同学们在学习“化学反应中的能量变化”时,进行了如下探究实验。
同学们在学习“化学反应中的能量变化”时,进行了如下探究实验。| 同学 | 实验方案 | 预测实验现象 | 结论 |
| 甲 | 向试管中滴加Na2CO3溶液 | 产生白色沉淀 | 猜想一成立 |
| 乙 | 向试管中通入CO2气体 | 产生白色沉淀 | 猜想二成立 |
| 丙 | 向试管中滴加NaOH溶液 | 产生白色沉淀 | 猜想三成立 |
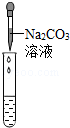
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 | 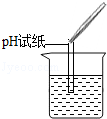 |
 |
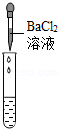 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
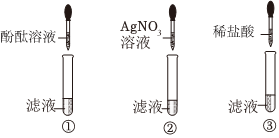
| 猜想 | 滤液成分 | 滤渣成分 |
| ① | AgNO3,Cu(NO3)2,Fe(NO3)2 | Ag |
| ② | Cu(NO3)2,Fe(NO3)2 | Ag、Fe |
| ③ | Cu(NO3)2,Fe(NO3)2 | Ag、Cu |
| ④ | Fe(NO3)2 | Ag、Cu |
| ⑤ | Fe(NO3)2 | Ag、Cu、Fe |
| 滤液 | 滤渣 | |
| 加入稀盐酸后现象 | 未出现白色沉淀 | 出现 |
| 结论 | 猜想 不成立 | 猜想⑤成立 |

| 甲同学 | 乙同学 | |
| 步骤 | 取少量废液于试管中,滴加AgNO3,溶液 | 取少量废液于试管中,滴加无色酚酞溶液 |
| 现象 | 产生白色沉淀 | 无变色现象 |
| 结论 | 废液中有HCl | 废液中无HCl |
| 实验步骤 | 现象 | 结论 |
| Ⅰ.取少量溶液M于试管中,滴加无色酚酞试液 | 试液变红 | 溶液中一定含有NaOH |
| Ⅱ.另取少量溶液M于试管中,滴加足量 。 | 有气泡产生 | 溶液中一定含有Na2CO3 |
| Ⅲ.另取少量溶液M于试管中,滴加过量BaCl2溶液,再取上层溶液加入酚酞试液 | 观察到 ,加入酚酞后无明显现象 | 溶液中一定只有Na2CO3,猜想一正确 |
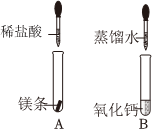
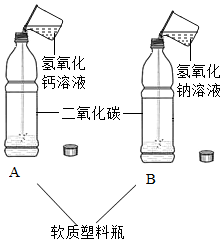 实验室在做有关CO2的性质实验中,用氢氧化钠溶液吸收CO2,而不用澄清石灰水,小喵同学想用以下A、B两组对比试验进行验证(实验后立即盖紧瓶盖并振荡);
实验室在做有关CO2的性质实验中,用氢氧化钠溶液吸收CO2,而不用澄清石灰水,小喵同学想用以下A、B两组对比试验进行验证(实验后立即盖紧瓶盖并振荡);| 实验方案 | 实验现象 | 实验结论 |
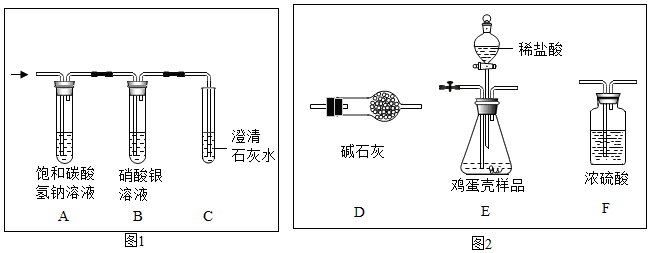
| 方案一:取少量滤液于试管中,滴加少量稀硫酸 | 无气泡产生 | 猜想三不成立 |
| 方案二:取少量滤液于试管 中,滴加几滴氯化钙溶液 |
猜想三成立 |
 实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图),化学小组的同学经过询问老师后知道是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断是否变质,化学小组的同学进行了如下的探究活动:
实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图),化学小组的同学经过询问老师后知道是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断是否变质,化学小组的同学进行了如下的探究活动:| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
| 常温下稀溶液的pH | 7 | 13 | 11 | 9 |

| 实验方案 | 滴加紫色石蕊试液 | 通入CO2 | 滴加Na2CO3溶液 |
| 实验操作 |
|
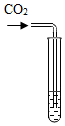
|
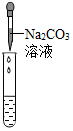
|
| 实验现象 | 石蕊试液变蓝 | 产生白色沉淀 | |
| 实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
 化学实验课上,老师拿来一瓶标签有破损的试剂瓶,里面盛有一种无色溶液(如图):
化学实验课上,老师拿来一瓶标签有破损的试剂瓶,里面盛有一种无色溶液(如图):| 实验方案 | 滴加酚酞溶液 | 吹入CO2气体 | 滴加X溶液 |
| 实验操作 |
|

|
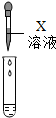
|
| 实验现象 |
② |
没有白色沉淀 | 产生白色沉淀 |
| 实验结论 | 第四组猜想不成立 | ③第 组猜想不成立 | 第三组猜想成立 |
| 方案 | 实验步骤 | 实验现象 |
| 方案一 | 加入少量氧化铜粉末 | ① |
| 方案二 | 加入② | 只有气泡产生 |
| 方案三 | 加入Na2CO3溶液至过量 | ③ |

gcc@dyw.com
2014-06-26
初中化学 | | 实验题