服务热线
搜题▪组卷
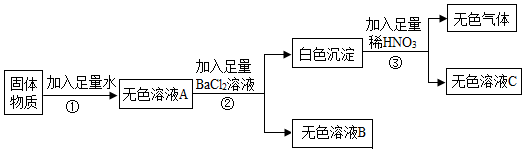
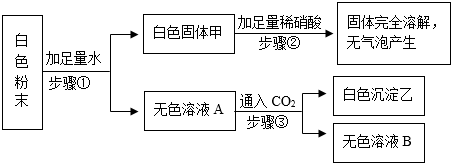

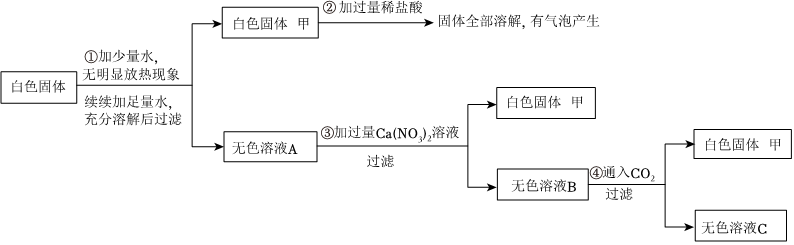
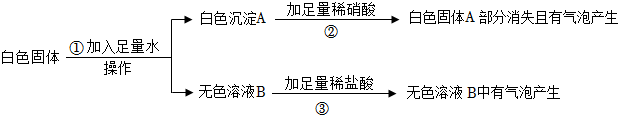
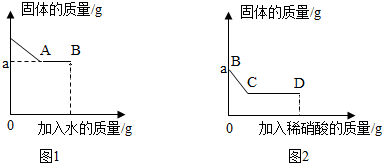
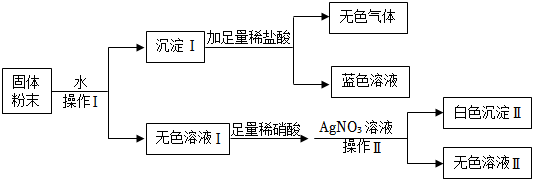
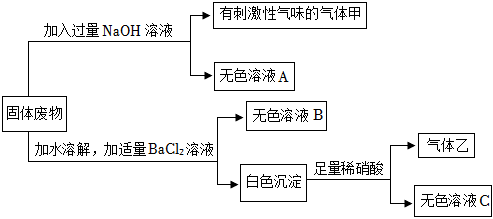
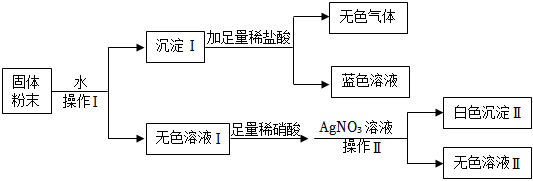
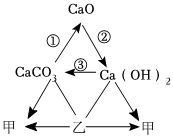

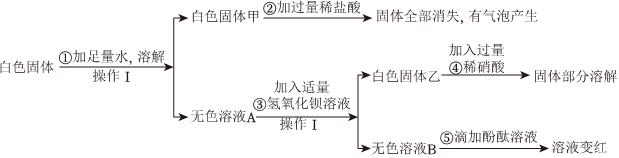
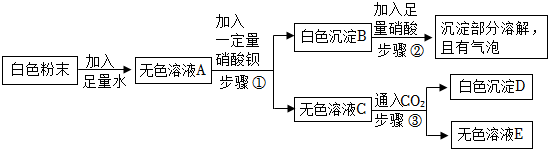
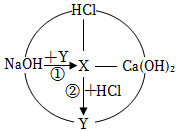 如图是初中常见物质的反应关系,其中X俗称苏打,“→”表示某物质可一步反应生成另一种物质,“—”表示两端的物质能相互反应(部分生成物已略去)。回答下列问题。
如图是初中常见物质的反应关系,其中X俗称苏打,“→”表示某物质可一步反应生成另一种物质,“—”表示两端的物质能相互反应(部分生成物已略去)。回答下列问题。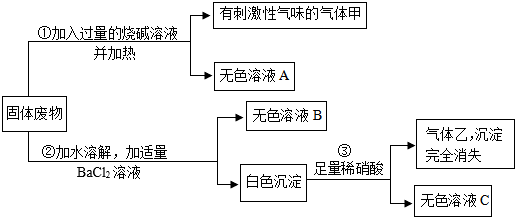

ki@dyw.com
2018-04-01
初中化学 | | 填空题