服务热线
搜题▪组卷
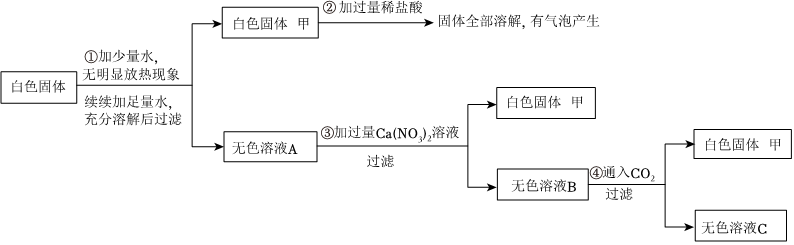

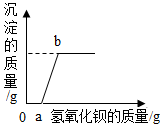 R溶液可能含有盐酸、硫酸、硝酸钠、氯化铜中的一种或几种,为了探究其组成,向一定质量的该溶液中逐滴加入氢氧化钡溶液,生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系如图所示。回答下列问题。
R溶液可能含有盐酸、硫酸、硝酸钠、氯化铜中的一种或几种,为了探究其组成,向一定质量的该溶液中逐滴加入氢氧化钡溶液,生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系如图所示。回答下列问题。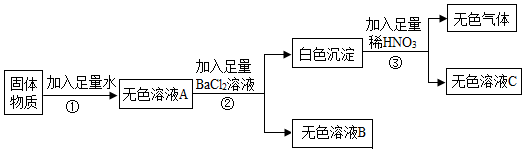
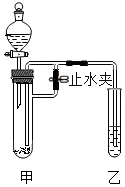 某化学小组在课外活动时按如图所示组装好仪器,在甲试管中装入碳酸钙,乙试管装入紫色石蕊溶液.
某化学小组在课外活动时按如图所示组装好仪器,在甲试管中装入碳酸钙,乙试管装入紫色石蕊溶液.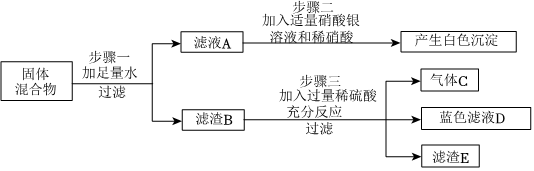
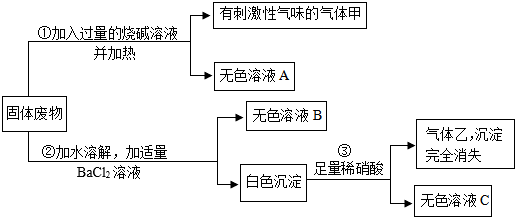
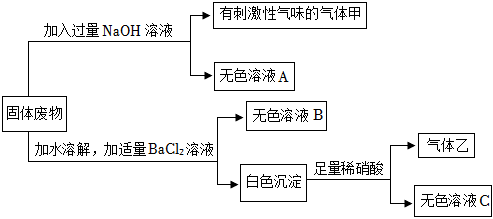
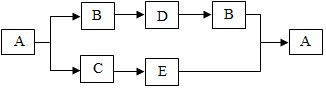
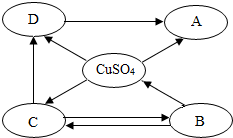 构建知识网络是学习化学的重要方法,如图是不同物质相互转化关系图。其中A、B、C、D属于不同类别的物质,且都含有铜元素,B为黑色粉末,C为红色粉末。“→”表示一种物质一步转化成另一种物质(部分反应物、生成物及反应条件未标出),请回答问题:
构建知识网络是学习化学的重要方法,如图是不同物质相互转化关系图。其中A、B、C、D属于不同类别的物质,且都含有铜元素,B为黑色粉末,C为红色粉末。“→”表示一种物质一步转化成另一种物质(部分反应物、生成物及反应条件未标出),请回答问题:

dm@dyw.com
2025-03-30
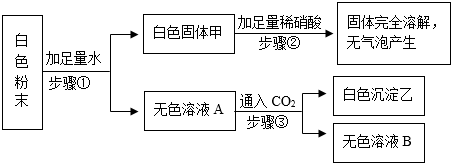
初中化学 | | 填空题