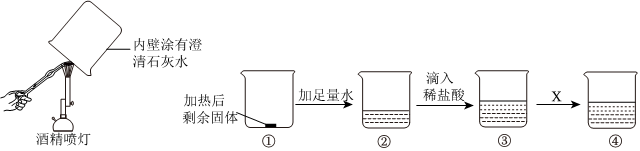
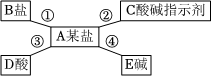
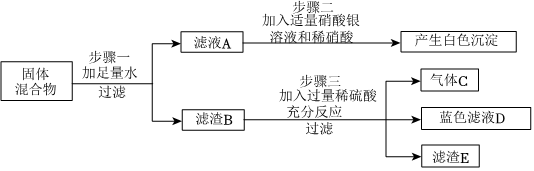
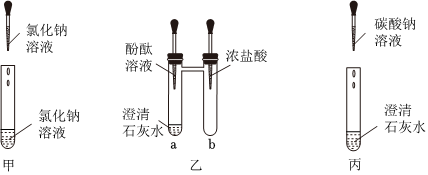
[解析]
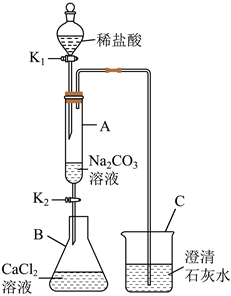
解:(1)打开K1,A中稀盐酸与碳酸钠反应生成氯化钠、水和二氧化碳,化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑。生成的二氧化碳气体进入C 中,二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊溶液变红,所以C中观察到的现象是紫色石蕊溶液变红。
(2)打开K1、K2,液体全部流入B中,B中氯化钙与碳酸钠反应产生白色沉淀碳酸钙。若A中碳酸钠没有剩余,就不会与B中的氯化钙反应产生沉淀,所以说明A中反应后一定没有HCl剩余(因为若有HCl剩余,会与生成的碳酸钙沉淀反应使其溶解 )。
(3)①取反应后B的上层清液,测其pH=7,说明溶液呈中性。因为CaCl2溶液呈中性,且反应后溶液中不存在碳酸钠(碳酸钠溶液呈碱性),氯化钙可能完全参加了反应,也可能有剩余,所以不能说明B中溶液一定含有CaCl2,故①错误。
②向反应后B的上层清液中滴入AgNO3溶液,产生白色沉淀。由于反应生成了氯化钠,氯化钠中的氯离子也能与硝酸银反应生成白色沉淀,所以不能确定溶液中一定含有CaCl2,故②错误。
③向反应后B的上层清液中滴入K2CO3溶液,产生白色沉淀,说明溶液中含有钙离子,进而说明B中溶液一定含有CaCl2,故③正确;
④向反应后B的上层清液中滴入稀盐酸,产生气泡,说明溶液中含有碳酸钠,说明溶液中没有CaCl2。
故选:③。
故答案为:
(1)Na2CO3+2HCl=2NaCl+H2O+CO2↑;紫色石蕊溶液变红;
(2)HCl;
(3)③。
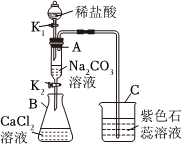
 用如图装置完成下列实验(夹持仪器已省略,K1、K2均关闭)。
用如图装置完成下列实验(夹持仪器已省略,K1、K2均关闭)。
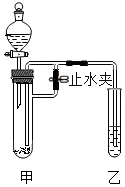 某化学小组在课外活动时按如图所示组装好仪器,在甲试管中装入碳酸钙,乙试管装入紫色石蕊溶液.
某化学小组在课外活动时按如图所示组装好仪器,在甲试管中装入碳酸钙,乙试管装入紫色石蕊溶液.