[考点]
实验探究物质的性质或变化规律,盐的化学性质,
[答案]
(1)不合理;
(2)固体全部溶解;
(3)2HCl+Ca(OH)2=CaCl2+2H2O;
(4)AB。
[解析]
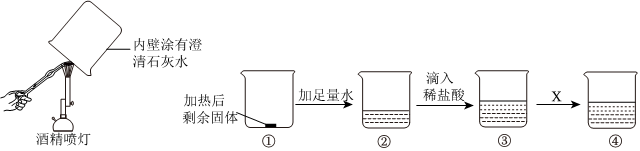
解:(1)酒精燃烧会生成二氧化碳和水,还可能是酒精燃烧生成的二氧化碳使澄清石灰水变浑浊,故此说法不合理;
(2)氧化钙和水反应生成氢氧化钙,氢氧化钙微溶于水,碳酸钙难溶于水,故加入足量的水,观察到烧杯②中固体全部溶解的现象,说明加热后剩余固体的成分只有CaO;
(3)氧化钙和水反应生成氢氧化钙,故加入稀盐酸后发生反应为氢氧化钙和稀盐酸反应生成氯化钙和水,反应的化学方程式为2HCl+Ca(OH)2=CaCl2+2H2O;
(4)A、若X是Mg,镁能与稀盐酸反应生成氯化镁和氢气,烧杯④中观察到产生气泡,则烧杯③中一定含有盐酸,盐酸和氢氧化钙反应生成了氯化钙,故烧杯③中一定含有氯化钙和氯化氢两种溶质,故A正确;
B、若X是无色酚酞溶液,无色酚酞试液遇到碱性溶液变红,烧杯④中无明显现象,说明氢氧化钙消失,说明烧杯③中发生了反应,故B正确;
C、若X是硝酸银溶液,硝酸银和盐酸、氯化钙均能反应生成氯化银白色沉淀,烧杯④中产生白色沉淀,不能说明烧杯③中稀盐酸过量,故C错误;
故选:AB。
故答案为:(1)不合理;
(2)固体全部溶解;
(3)2HCl+Ca(OH)2=CaCl2+2H2O;
(4)AB。
[点评]
本题考查了"实验探究物质的性质或变化规律,盐的化学性质,",属于"易错题",熟悉题型是解题的关键。
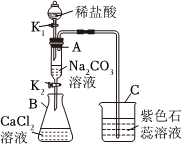
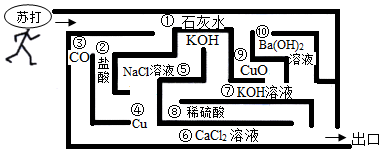
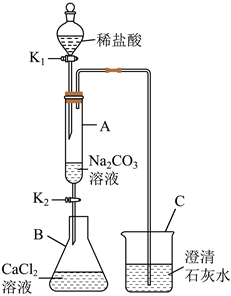 用如图装置完成下列实验(夹持仪器已省略,K1、K2均关闭)。
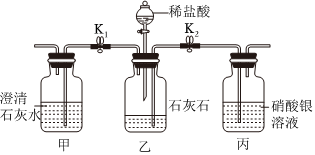
用如图装置完成下列实验(夹持仪器已省略,K1、K2均关闭)。

 ?
?