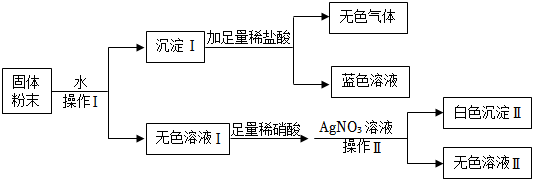
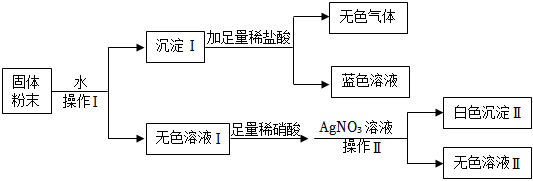
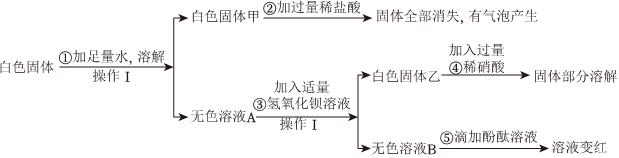
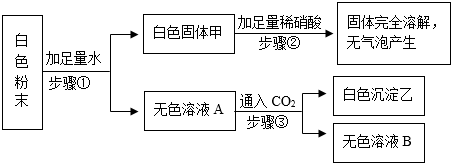
[答案]
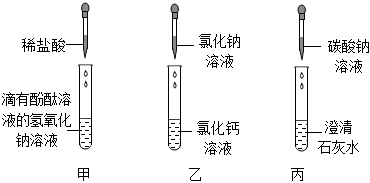
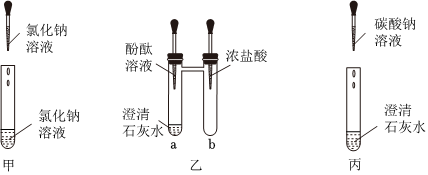
(1)不能;
(2)溶液先变红,后逐渐变为无色;
(3)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(4)两。
[解析]
解:(1)氯化钙与氯化钠相互交换成分后产物中没有沉淀或气体或水,不符合复分解反应的条件,不能发生反应,不能验证盐溶液与盐溶液能发生化学反应;
(2)试管a中是澄清石灰水(氢氧化钙溶液),滴入无色酚酞溶液,溶液变红;再将足量浓盐酸滴入试管b中,浓盐酸具有挥发性,挥发出的氯化氢气体进入试管a,与氢氧化钙反应生成氯化钙和水,氯化钙溶液显中性,随着反应进行,氢氧化钙逐渐被消耗,溶液碱性减弱,所以溶液由红色逐渐变为无色;整个实验过程中,试管a中的现象是溶液先变红,后逐渐变为无色;
(3)丙试管中碳酸钠和氢氧化钙生成碳酸钙沉淀和氢氧化钠,反应的化学方程式Na2CO3+Ca(OH)2 = CaCO3↓+2NaOH;
(4)废液缸内先有气泡产生,说明有酸和碳酸盐反应,丙试管中含碳酸钠,所以甲试管中稀盐酸有剩余;静置后底部有白色沉淀,是因为碳酸钠与氯化钙或氢氧化钙反应生成了碳酸钙沉淀;上层清液呈红色,说明溶液显碱性。所以混合前甲试管内除酚酞外,还有反应生成的氯化钠以及过量的氯化氢。
故答案为:(1)不能;
(2)溶液先变红,后逐渐变为无色;
(3)Na2CO3+Ca(OH)2 = CaCO3↓+2NaOH;
(4)两。
[点评]
本题考查了"碱的化学性质,盐的化学性质,",属于"易错题",熟悉题型是解题的关键。
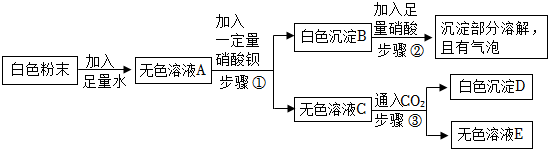
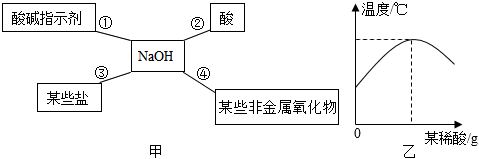
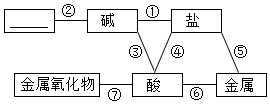 归纳是学习化学的重要方法。小明总结出如图所示的物质之间的反应关系(图中短线连接的物质表示能相互反应)。若图中的酸为盐酸,根据题目回答下面的问题。
归纳是学习化学的重要方法。小明总结出如图所示的物质之间的反应关系(图中短线连接的物质表示能相互反应)。若图中的酸为盐酸,根据题目回答下面的问题。