服务热线
搜题▪组卷
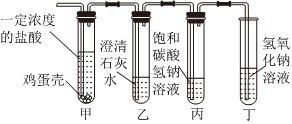
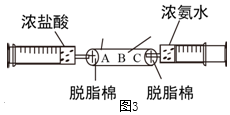
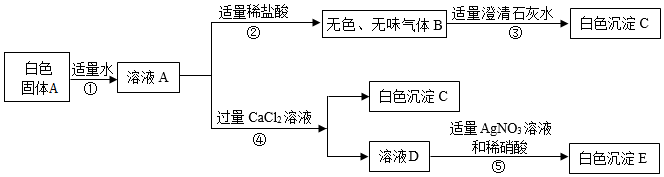
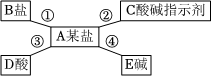
 用如图装置完成下列实验(夹持仪器已省略,K1、K2均关闭)。
用如图装置完成下列实验(夹持仪器已省略,K1、K2均关闭)。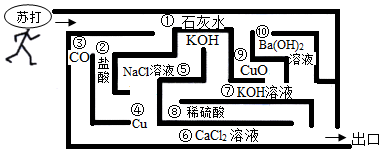
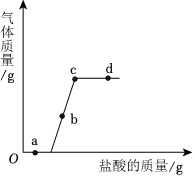
| 时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 质量/g | 92.0 | 91.0 | 90.5 | 90.2 | 90.4 | 90.1 | 90.1 | 90.1 | 90.1 |
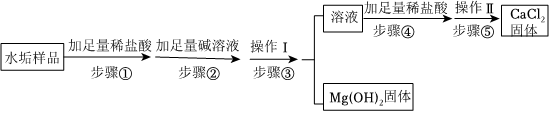
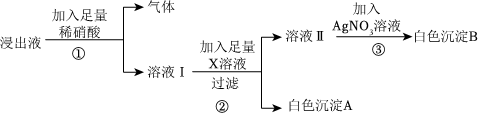 ?
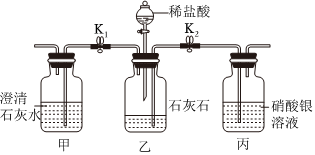
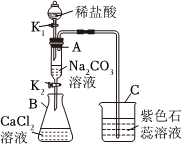
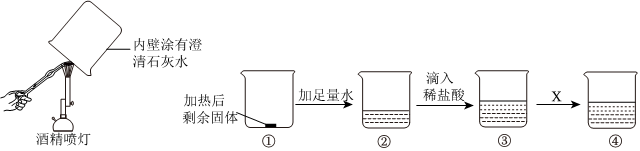
?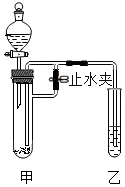 某化学小组在课外活动时按如图所示组装好仪器,在甲试管中装入碳酸钙,乙试管装入紫色石蕊溶液.
某化学小组在课外活动时按如图所示组装好仪器,在甲试管中装入碳酸钙,乙试管装入紫色石蕊溶液.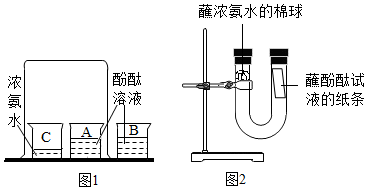

dyhx2019
2019-06-30
初中化学 | | 填空题