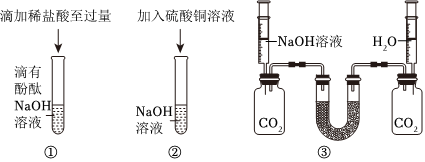
[考点]
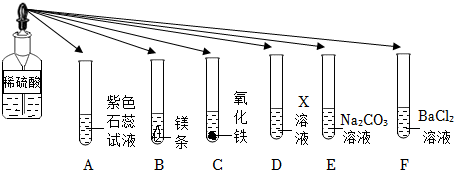
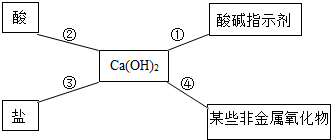
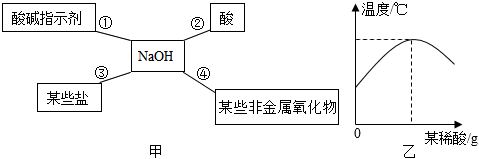
酸的化学性质,碱的化学性质,盐的化学性质,
[答案]
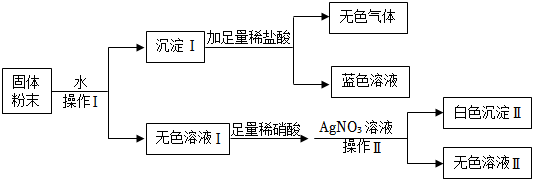
(1)由红色变为无色;
(2)不符合复分解反应发生的条件(即没有沉淀、气体或水生成);碳酸钠(合理即可);
(3)Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(4)NaCl、HCl。
[解析]
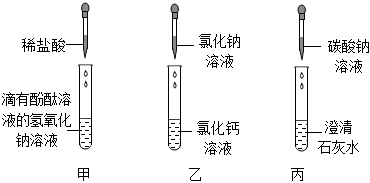
解:(1)由红色变为无色解析:甲试管中是氢氧化钠溶液,滴有酚酞,溶液呈红色。滴加稀盐酸时,盐酸与氢氧化钠发生中和反应,随着氢氧化钠被消耗,溶液碱性逐渐减弱,当恰好完全反应时,溶液呈中性,此时溶液由红色变为无色,可证明二者发生了反应。
(2)乙不发生反应的原因:氯化钠与氯化钙相互交换成分后,没有沉淀、气体或水生成,不满足复分解反应发生的条件。可替换溶液:碳酸钠(合理即可)。碳酸钠与氯化钙反应会生成碳酸钙白色沉淀,能验证盐溶液与盐溶液发生化学反应。
(3)丙试管中是碳酸钠溶液与澄清石灰水(氢氧化钙溶液)反应,二者发生复分解反应,相互交换成分生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(4)废液缸内先有气泡产生,说明有酸和碳酸盐反应,丙试管中含碳酸钠,所以甲试管中稀盐酸有剩余;静置后底部有白色沉淀,是因为碳酸钠与氯化钙或氢氧化钙反应生成了碳酸钙沉淀;上层清液呈红色,说明溶液显碱性。所以混合前甲试管内除酚酞外,还有反应生成的氯化钠以及过量的氯化氢。
故答案为:(1)由红色变为无色;
(2)不符合复分解反应发生的条件(即没有沉淀、气体或水生成 );碳酸钠(合理即可);
(3)Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(4)NaCl、HCl。
[点评]
本题考查了"酸的化学性质,碱的化学性质,盐的化学性质,",属于"难典题",熟悉题型是解题的关键。

 体验蛋雕艺术,传承非遗文化。兴趣小组用化学方法制作蛋雕:将蛋壳在熔化的石蜡中裹上蜡衣,用金属丝划穿蜡衣雕刻出花纹,吸取稀盐酸滴在划痕处,一段时间后放入热水中熔去多余的蜡,做成蛋雕作品。
体验蛋雕艺术,传承非遗文化。兴趣小组用化学方法制作蛋雕:将蛋壳在熔化的石蜡中裹上蜡衣,用金属丝划穿蜡衣雕刻出花纹,吸取稀盐酸滴在划痕处,一段时间后放入热水中熔去多余的蜡,做成蛋雕作品。