[考点]
探究酸碱的主要性质,酸的化学性质,中和反应及其应用,溶液的酸碱性与pH的关系,
[答案]
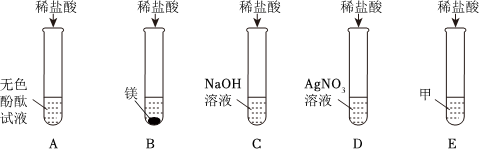
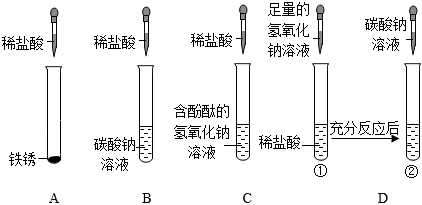
(1)Fe2O3+6HCl=2FeCl3+3H2O;
(2)NaCl、HCl;
(3)溶液由红色变为无色;
(4)无气泡产生;BD。
[解析]
解:(1)实验A中,铁锈的主要成分是氧化铁,氧化铁和稀盐酸反应生成氯化铁和水,该反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;
(2)实验B中碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,反应后,测得溶液pH<7,则稀盐酸过量,则溶质为:NaCl、HCl;
(3)氢氧化钠溶液显碱性,能使无色酚酞试液变红,滴入稀盐酸,氢氧化钠和盐酸反应生成氯化钠和水,氯化钠显中性,稀盐酸显酸性,均不能使无色酚酞试液变色,故溶液由红色变为无色,说明氢氧化钠和稀盐酸发生了反应;
(4)实验D中,碳酸钠能与稀盐酸反应生成氯化钠、二氧化碳和水,故向反应后溶液中加入碳酸钠溶液,如果无气泡产生,说明氢氧化钠和稀盐酸发生了反应,稀盐酸消失;
A、硝酸银和氯化钠、盐酸均能反应生成氯化银白色沉淀,无法验证是否发生了中和反应,不符合题意;
B、紫色石蕊试液遇酸变红,遇碱变蓝,在中性溶液中不变色,如果向反应后溶液中加入紫色石蕊试液,溶液变蓝或不变色,说明稀盐酸已经完全反应,符合题意;
C、在金属活动性顺序里,铜排在氢后,铜和稀盐酸不反应,无法验证是否发生了中和反应,不符合题意;
D、氧化铜能与稀盐酸反应生成氯化铜和水,如果无明显现象,说明稀盐酸消失,说明氢氧化钠和稀盐酸发生了中和反应,符合题意。
故答案为:(1)Fe2O3+6HCl=2FeCl3+3H2O;
(2)NaCl、HCl;
(3)溶液由红色变为无色;
(4)无气泡产生;BD。
[点评]
本题考查了"探究酸碱的主要性质,酸的化学性质,中和反应及其应用,溶液的酸碱性与pH的关系,",属于"综合题",熟悉题型是解题的关键。
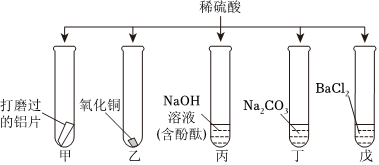
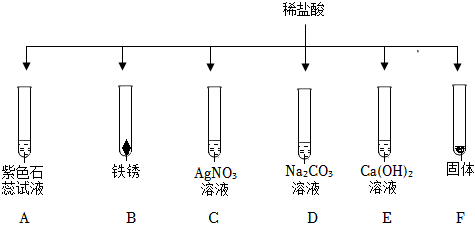
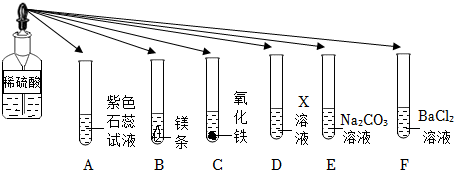
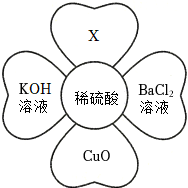 如图所示,稀硫酸能与相连的物质发生化学反应。
如图所示,稀硫酸能与相连的物质发生化学反应。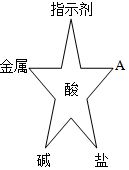 在化学复习课上,同学们对酸的化学性质进行了梳理和概括,并用如图表达了他们的研究成果。请你根据图回答下列问题。
在化学复习课上,同学们对酸的化学性质进行了梳理和概括,并用如图表达了他们的研究成果。请你根据图回答下列问题。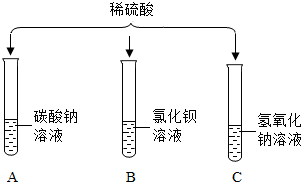
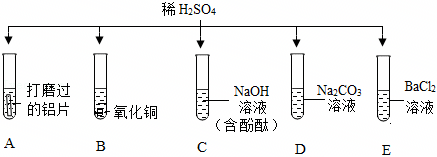
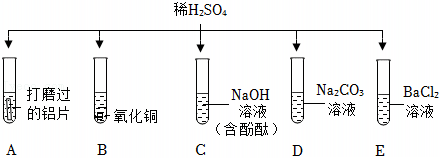
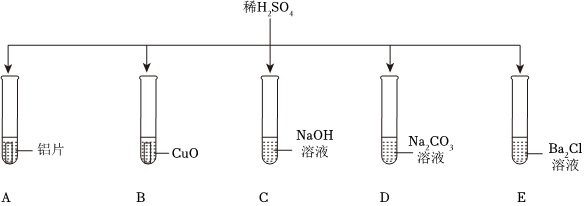
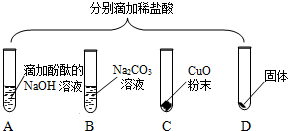 为验证“酸的化学通性”,某班同学在实验室进行如图实验。请分析并回答相关问题:
为验证“酸的化学通性”,某班同学在实验室进行如图实验。请分析并回答相关问题: