服务热线
 金属的利用史成就卓越,是劳动人民生产与生活智慧的结晶。
金属的利用史成就卓越,是劳动人民生产与生活智慧的结晶。

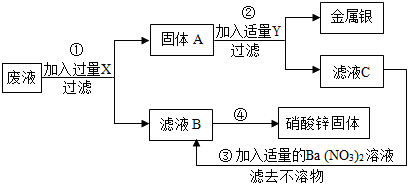
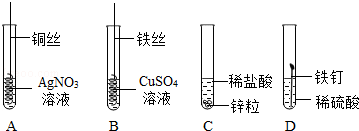
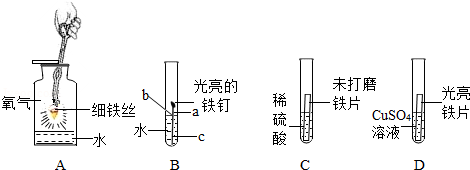
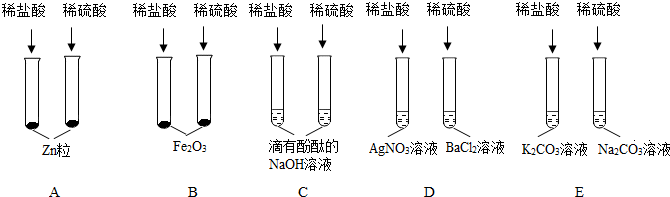
 化学变化中常随着美丽的现象,镁条在空气中燃烧时发出 ,放出大量的热,生成白色粉末状固体,镁燃烧的化学方程式 ,铜在空气中加热表面变黑,用化学方程式表示发生的化学反应 。如图实验中观察到的现象是 。
化学变化中常随着美丽的现象,镁条在空气中燃烧时发出 ,放出大量的热,生成白色粉末状固体,镁燃烧的化学方程式 ,铜在空气中加热表面变黑,用化学方程式表示发生的化学反应 。如图实验中观察到的现象是 。
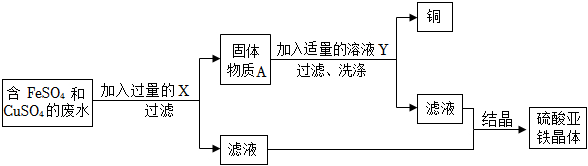
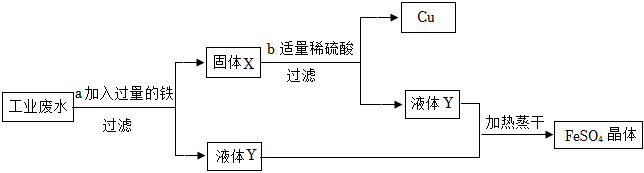
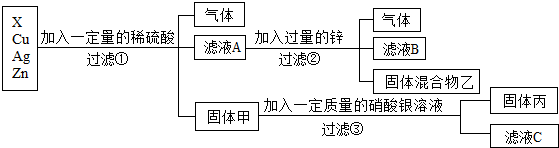
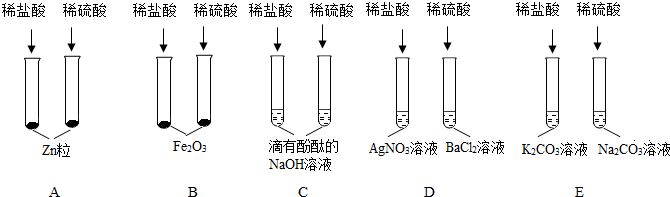
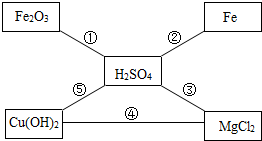 学完酸碱盐的性质后,老师给出五种物质,要求一定条件下所有能发生反应的两种无致癌之间用“-”连接.如图为小明的答案.
学完酸碱盐的性质后,老师给出五种物质,要求一定条件下所有能发生反应的两种无致癌之间用“-”连接.如图为小明的答案.
dyhx2021
2013-12-12
初中化学 | | 填空题