[考点]
合金与合金的性质,金属的化学性质,金属活动性顺序及其应用,
[答案]
(1)硬度;
(2)铜表面有银白色固体产生,溶液由无色变为蓝色;A和D;
(3)a。
[解析]
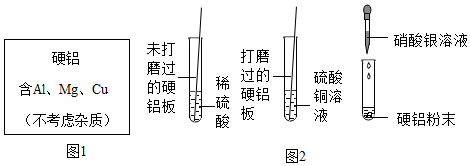
(1)“金柔锡柔,合两柔则刚”,说明铜锡合金比组成它的纯金属的硬度大,表明我们的祖先已认识到铜锡合金与纯铜硬度的不同;
(2)实验②中通和硝酸银反应生成银和硝酸铜,可观察到铜表面有银白色固体产生,溶液由无色变为蓝色;
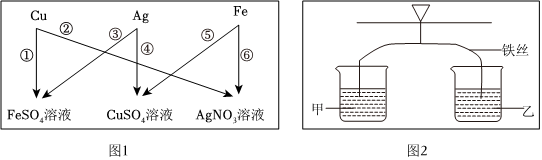
A、①中铜不能与硫酸亚铁反应,说明铁比铜活泼;②中铜能与硝酸银反应,说明铜比银活泼,即可验证三种金属的活动性顺序为铁>铜>银,故正确;
B、③中银不能与硫酸亚铁反应,说明铁比银活泼;④中银不能与硫酸铜反应,说明铜比银活泼,但是无法比较铁和铜的活动性强弱,故错误;
C、⑤中铁能与硫酸铜反应,说明铁比铜活泼;⑥中铁能与硝酸银反应,说明铁比银活泼,但是无法比较铜和银的活动性强弱,故错误;
D、②中铜能与硝酸银反应,说明铜比银活泼;⑤中铁能与硫酸铜反应,说明铁比铜活泼;即可验证三种金属的活动性顺序为铁>铜>银,故正确;
故选:AD;
(3)a、甲烧杯中为硝酸铜时,Fe与Cu(NO3)2反应生成Fe(NO3)2和Cu,化学方程式为:Fe+Cu(NO3)2=Fe(NO3)2+Cu,每56份质量的铁能置换出64份质量的铜,生成的Cu 会附着在铁丝表面,随着反应进行,左侧固体质量逐渐增大;乙烧杯中为稀盐酸,Fe与稀盐酸反应生成FeCl2和H2,化学方程式为:Fe+2HCl=FeCl2+H2↑,随着反应进行,右侧铁丝质量逐渐减小,因此铁丝左端下沉,故正确;
b、甲烧杯中为稀硫酸时,铁和稀硫酸反应生成硫酸亚铁和氢气,化学方程式为:Fe+H2SO4=FeSO4+H2↑,随着反应进行,左侧铁丝质量逐渐减小;乙烧杯中为硝酸镁时,铁和硝酸镁不反应,右侧铁丝质量不变,因此铁丝右端下沉,故错误;
c、甲烧杯中为硝酸锌时,铁和硝酸锌不反应,左侧铁丝质量不变;乙烧杯中为硝酸银时,铁和硝酸银反应生成硝酸亚铁和银,化学方程式为:Fe+2AgNO3=Fe(NO3)2+2Ag,每56份质量的铁能置换出216份质量的银,生成的Ag会附着在铁丝表面,随着反应进行,右侧固体质量逐渐增大,因此铁丝右端下沉,故错误。
故答案为:
(1)硬度;
(2)铜表面有银白色固体产生,溶液由无色变为蓝色;A和D;
(3)a。
[点评]
本题考查了"合金与合金的性质,金属的化学性质,金属活动性顺序及其应用,",属于"难典题",熟悉题型是解题的关键。
 ?
?
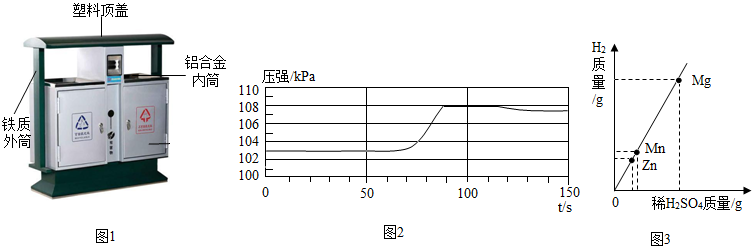 (1)空易拉罐应放入 (选填可回收物或其它垃圾)筒中。
(1)空易拉罐应放入 (选填可回收物或其它垃圾)筒中。
 ?
? ?
?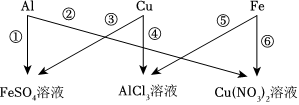 为验证铝、铜、铁的金属活动性顺序,同学们设计了如图所示的6个实验(“→”表示将金属丝加入盐溶液中)。
为验证铝、铜、铁的金属活动性顺序,同学们设计了如图所示的6个实验(“→”表示将金属丝加入盐溶液中)。