[解析]
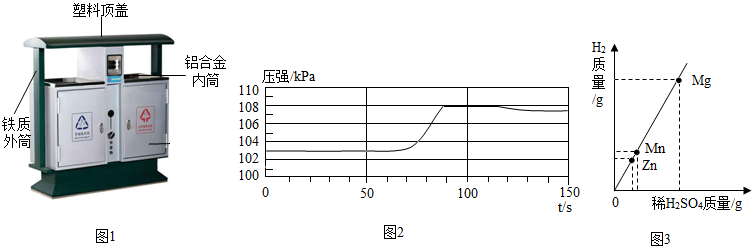
解:(1)易拉罐属于可回收垃圾;
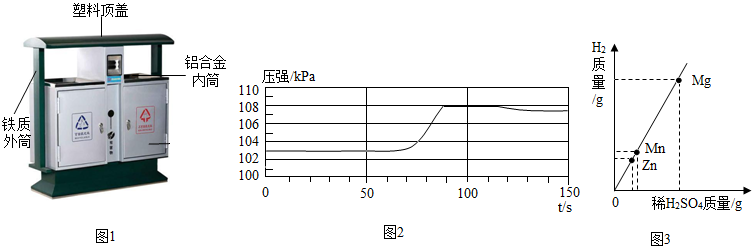
(2)垃圾桶内筒材料使用铝合金,铝合金比纯铝的优点是:硬度大,塑性好;
(3)铁丝和硫酸铜溶液反应生成硫酸亚铁和铜,实验现象有:铁丝表面有红色固体出现,充分反应后,溶液由蓝色变成浅绿色;
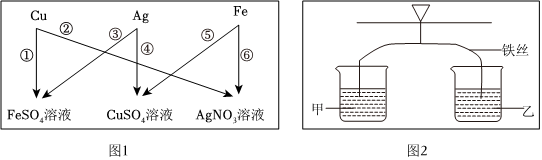
(4)铝和氧气中的反应生成氧化铝,氧化铝和盐酸反应生成氯化铝和水,铝和盐酸反应生成氯化铝和氢气,
①开始阶段压强增大不明显的原因可能是:未打磨的铝合金表面有一层致密的氧化铝薄膜,盐酸先和氧化铝反应;
②装置内的压强从60s开始增大,60s时,氧化铝和稀盐酸反应生成了氧化铝和水,溶液中的阳离子有H+、Al3+;
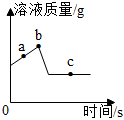
(5)A、由图中信息不能判断三种金属的活动性顺序,故A错误;
B、三种金属和稀硫酸反应生成的硫酸盐中金属元素的化合价都是+2,生成氢气质量越小,金属相对原子质量越大,由表中信息可知,生成氢气质量由大到小的顺序是锌、锰、镁,因此三种金属的相对原子质量:Mg<Mn<Zn,故B正确;
C、生成氢气质量越大,消耗硫酸质量越大,因此三种金属消耗稀H2SO4的质量:Mg>Mn>Zn,故C正确;
D、生成氢气质量越大,反应后形成溶液质量质量越小,因此三种金属与稀H2SO4反应后溶液的质量:Mg<Mn<Zn,故D正确。
故选:BCD。
故答案为:(1)可回收物;
(2)硬度大,塑性好;
(3)溶液由蓝色变成浅绿色;
(4)①未打磨的铝合金表面有一层致密的氧化铝薄膜,盐酸先和氧化铝反应;
②H+、Al3+;
(5)BCD。
 (1)空易拉罐应放入 (选填可回收物或其它垃圾)筒中。
(1)空易拉罐应放入 (选填可回收物或其它垃圾)筒中。
 (1)空易拉罐应放入 (选填可回收物或其它垃圾)筒中。
(1)空易拉罐应放入 (选填可回收物或其它垃圾)筒中。
 ?
? 金属材料广泛应用于生产生活中。请回答下列问题:
金属材料广泛应用于生产生活中。请回答下列问题: