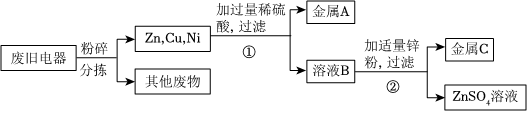
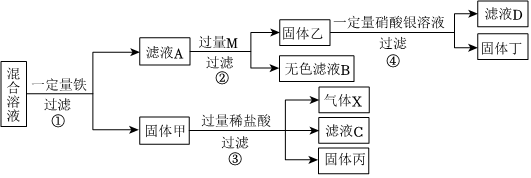
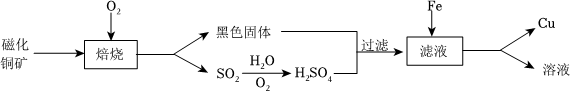
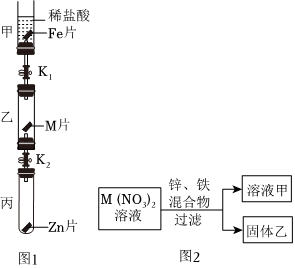
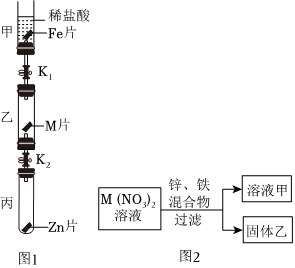
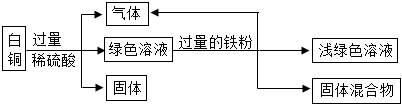
[解析]
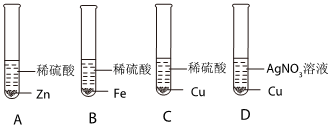
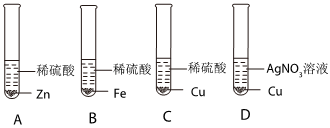
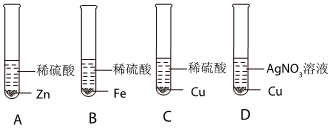
解:(1)由金属活动性顺序表可知,镁是氢前金属,银、金是氢后金属,所以能与稀盐酸发生反应的金属是镁,镁与盐酸反应生成氯化镁和氢气,则“消失”的金属是镁;
(2)由锰片和锌片周围立即产生气泡,且锰的速率较快,可得锰的活动性大于锌的活动性;由铜片上无明显现象,可知铜不与盐酸反应,铜的活动性最弱,所以锌、铜、锰的金属活动性顺序由强到弱为锰>锌>铜;
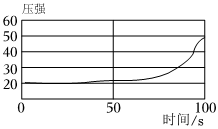
(3)0﹣50s时,容器内压强几乎不变,是因为铝和空气中的氧气反应会生成氧化铝薄膜,硫酸会先与氧化铝反应生成硫酸铝和水,没有气体生成;50s以后容器内压强逐渐增大,是因为铝和稀硫酸反应生成硫酸铝和氢气,有气体生成,化学方程式为:2Al+3H2SO4=Al2(SO4)3+3H2↑。
故答案为:
(1)镁;
(2)锰>锌>铜;
(3)铝表面的氧化铝与稀硫酸反应生成了硫酸铝和水,没有气体生成;2Al+3H2SO4=Al2(SO4)3+3H2↑。



 ?
? ?
?