[考点]
合金与合金的性质,金属活动性顺序及其应用,
[答案]
(1)硬度大或熔点低(合理即可);
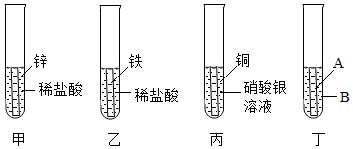
(2)①Zn+2HCl═ZnCl2+H2↑或Sn+2HCl═SnCl2+H2↑;
②不能;金属与稀盐酸的接触面积不同,会影响反应速率(合理即可)。
[解析]
解:(1)合金的强度和硬度一般比组成它的纯金属更高,抗腐蚀性能等也比组成它的纯金属更好;但是,大多数合金的熔点比它的纯金属的熔点低,所以与赤铜相比,黄铜、青铜具有的特性有
硬度大或熔点低等;
(2)①锌可以与稀盐酸反应生成氯化锌和氢气,化学方程式为Zn+2HCl═ZnCl2+H2↑,锡可以与稀盐酸反应生成氯化锡和氢气,化学方程式为Sn+2HCl═SnCl2+H2↑;
②在上述实验中并没有控制变量,金属与稀盐酸的接触面积不同,粉末状的金属比颗粒状的金属与酸接触面积大,会影响反应速率,所以不能确定三种金属的活动性顺序。
故答案为:(1)硬度大或熔点低(合理即可);
(2)①Zn+2HCl═ZnCl2+H2↑或Sn+2HCl═SnCl2+H2↑;
②不能;金属与稀盐酸的接触面积不同,会影响反应速率(合理即可)。
[点评]
本题考查了"合金与合金的性质,金属活动性顺序及其应用,",属于"易错题",熟悉题型是解题的关键。
 实验中一个能发生反应的化学方程式 。
实验中一个能发生反应的化学方程式 。

 ?
?