[解析]
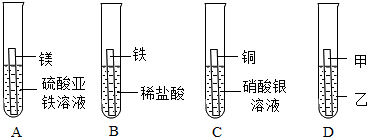
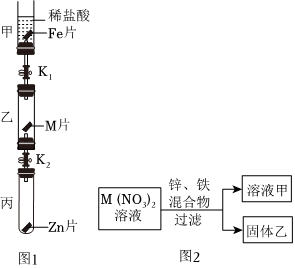
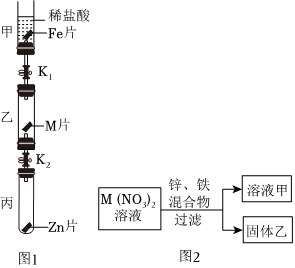
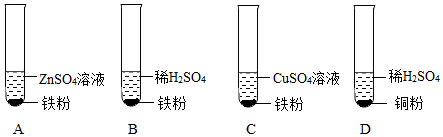
解:(1)在金属活动性顺序中,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,A实验的目的是比较镁、铁的金属活动性强弱。
(2)铁能与稀盐酸反应生成氯化亚铁溶液和氢气,B实验中观察到的现象是铁片逐渐溶解,有气泡产生,溶液由无色变为浅绿色。
(3)C实验中铜与硝酸银反应生成硝酸铜和银,反应的化学方程式为Cu+2AgNO3═Cu(NO3)2+2Ag。
(4)通过A、B、C可以得出镁>铁>氢,铜>银,还需证明铁和铜的金属活动性强弱,则D实验中物质甲、乙分别为铁、硫酸铜溶液(或铜、硫酸亚铁,合理即可)。
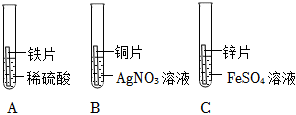
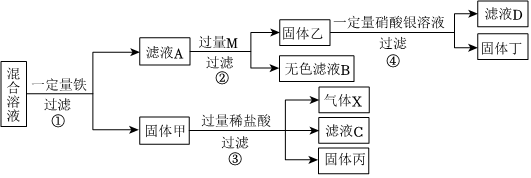
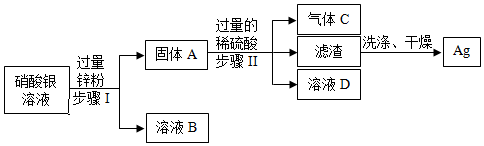
(5)锌的金属活动性比银、铜强,将一定量的锌粉加入硝酸银和硝酸铜的混合溶液中,锌先与硝酸银反应生成硝酸锌和银,硝酸银反应完,若还有锌粉,锌才能与硝酸铜反应生成硝酸锌和铜,若所得溶液为蓝色,说明滤液中含有硝酸铜,硝酸银可能有剩余,也可能恰好完全反应,则滤液中一定含有的金属离子是锌离子和铜离子。若向所得滤渣中加入一定量的稀硫酸,有气泡产生,说明滤渣中含有能与稀硫酸反应的锌,因为铜、银与稀硫酸均不反应,说明锌是过量的,则滤渣中一定含有锌、铜、银。
故答案为:
(1)比较镁、铁的金属活动性强弱
(2)铁片逐渐溶解,有气泡产生,溶液由无色变为浅绿色;
(3)Cu+2AgNO3═Cu(NO3)2+2Ag;
(4)铁、硫酸铜溶液(或铜、硫酸亚铁,合理即可);
(5)锌离子、铜离子;锌、铜、银。



 ?
?