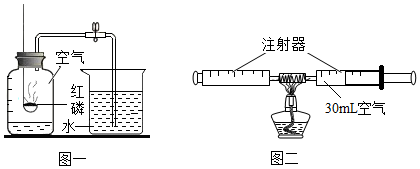
[考点]
二氧化碳的实验室制法,收集二氧化碳的方法及装置的选用,二氧化碳的物理性质,二氧化碳的化学性质,书写化学方程式、文字表达式、电离方程式,
[答案]
(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;C或D;
(2)能;
(3)可以控制反应速率;d;
(4)氧气和水蒸气。
[解析]
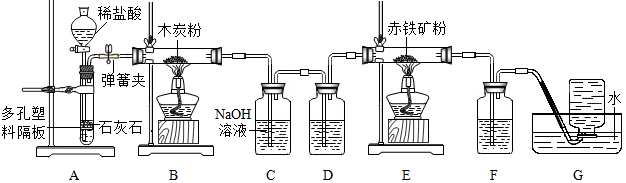
解:(1)实验室常用大理石(或石灰石)和稀盐酸反应制取二氧化碳,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,该反应属于固、液常温型,适合用装置C或D作发生装置,其突出特点是能随时控制反应的发生与停止;
(2)将制取的二氧化碳气体通入E装置中,可观察到蜡烛火焰熄灭,该现象能证明二氧化碳的密度大于空气;
(3)装置B中,通过分液漏斗可以控制液体的滴加速率和滴入的量,进而控制反应的速率;通常情况下乙炔是一种无色、无味的气体,密度比空气略小,难溶于水,若要收集较纯净的乙炔气体,可用排水法收集,则应将气体从d通入;
(4)浓硫酸具有吸水性,不和二氧化碳、氧气反应,然后通过饱和的氢氧化钠溶液,氢氧化钠溶液能和二氧化碳反应,不和氧气反应,氧气会从氢氧化钠溶液中带出水蒸气,所以最终得到的气体中含有氧气和水蒸气。
故答案为:
(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;C或D;
(2)能;
(3)可以控制反应速率;d;
(4)氧气和水蒸气。
[点评]
本题考查了"二氧化碳的实验室制法,收集二氧化碳的方法及装置的选用,二氧化碳的物理性质,二氧化碳的化学性质,书写化学方程式、文字表达式、电离方程式,",属于"压轴题",熟悉题型是解题的关键。
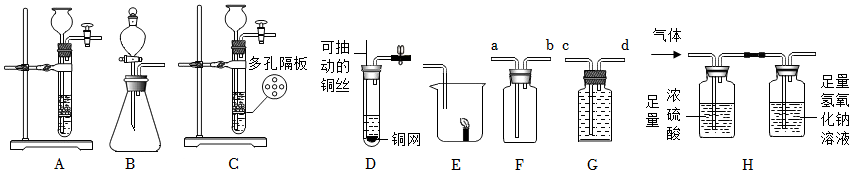
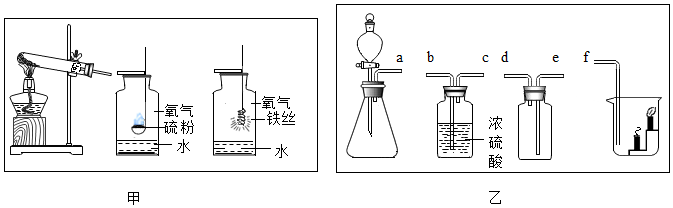
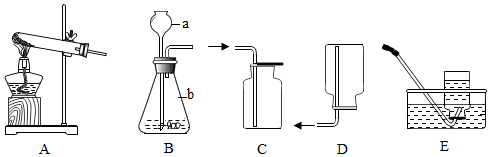
 实验装置(如图),既可用于制取气体,又可用于验证物质性质。
实验装置(如图),既可用于制取气体,又可用于验证物质性质。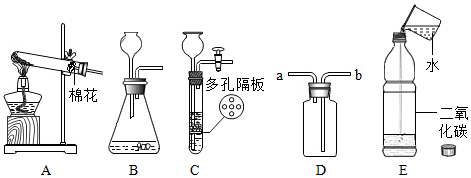
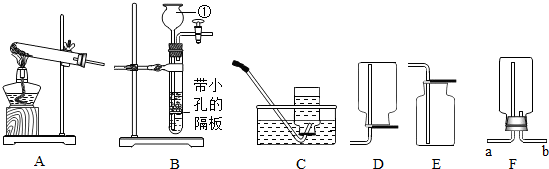
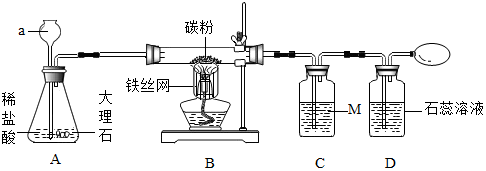
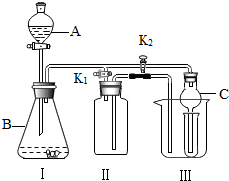
 某同学按如图装置用大理石和稀盐酸制取干燥的CO2。
某同学按如图装置用大理石和稀盐酸制取干燥的CO2。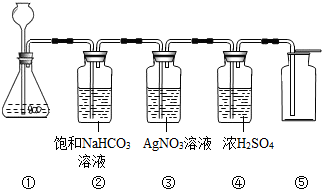 在实验室中,同学们用如图装置制取纯净干燥的CO2.
在实验室中,同学们用如图装置制取纯净干燥的CO2.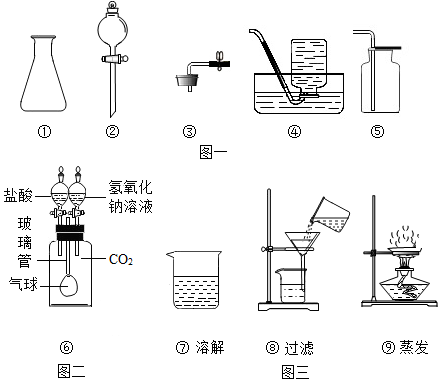
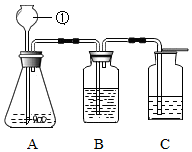
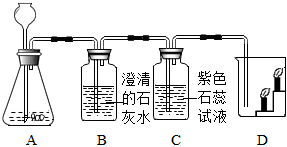 兴趣小组同学分组在实验室设计用大理石和稀盐酸完成实验室制备二氧化碳并验证二氧化碳性质的实验,如图所示:
兴趣小组同学分组在实验室设计用大理石和稀盐酸完成实验室制备二氧化碳并验证二氧化碳性质的实验,如图所示: