[考点]
二氧化碳的实验室制法,制取二氧化碳实验的改进,碱的化学性质,
[答案]
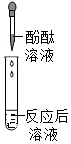
(1)长颈漏斗的下端没有伸入液面以下;CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)浓硫酸;fgcbe;
(3)CO2+2NaOH=Na2CO3+H2O;AD。
[解析]
解:(1)装置A中长颈漏斗的下端没有伸入液面以下,会造成生成的气体从长颈漏斗逸出;实验室常用改进后的A装置制备二氧化碳,即碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,该反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
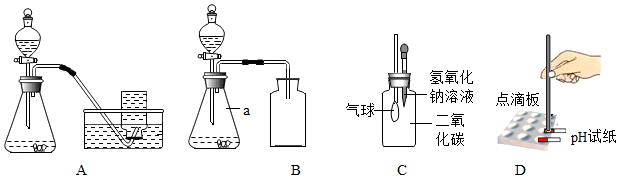
(2)选用A、B、D、E四个装置来制取并收集纯净、干燥的CO2气体。装置E的作用是吸收HCl气体,B中应盛放的液体是浓硫酸(吸收水分,干燥气体的作用),制取的二氧化碳中混有氯化氢气体和水蒸气,所以先通过盛有碳酸氢钠溶液的装置E除去氯化氢,然后再通过盛有浓硫酸的装置B除去水蒸气,最后用向上排空气法收集(由于二氧化碳密度比空气大)即可,气体进入洗气瓶的方式为长进短出,故正确的接口顺序从左到右依次为:a接fgcbe;
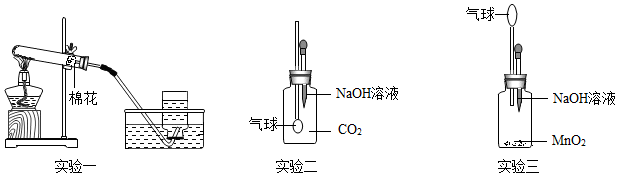
(3)用F装置进行实验,二氧化碳与氢氧化钠反应生成碳酸钠和水,导致装置内的压强变小,外界大气压将水槽中的氢氧化钠溶液经过长导管压入圆底烧瓶中,形成“喷泉”现象,化学方程式为CO2+2NaOH=Na2CO3+H2O;
A、SO2气体能与氢氧化钠反应,造成装置内的压强减小而形成“喷泉”现象,故A正确;
B、氢气不能与氢氧化钠溶液反应,不能形成喷泉,故B错误;
C、CO与氢氧化钠溶液不反应,不能形成喷泉,故C错误;
D、氯化氢气体能与氢氧化钠溶液反应,造成装置内的压强减小而形成“喷泉”现象,故D正确;
故选:AD。
故答案为:(1)长颈漏斗的下端没有伸入液面以下;CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)浓硫酸;fgcbe;
(3)CO2+2NaOH=Na2CO3+H2O;AD。
[点评]
本题考查了"二氧化碳的实验室制法,制取二氧化碳实验的改进,碱的化学性质,",属于"难典题",熟悉题型是解题的关键。
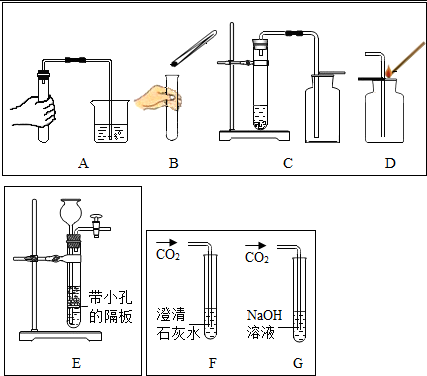
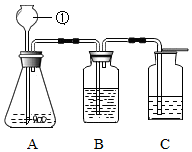 某同学按如图装置用大理石和稀盐酸制取干燥的CO2。
某同学按如图装置用大理石和稀盐酸制取干燥的CO2。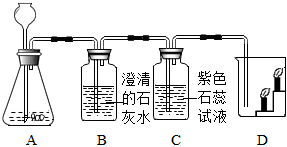 兴趣小组同学分组在实验室设计用大理石和稀盐酸完成实验室制备二氧化碳并验证二氧化碳性质的实验,如图所示:
兴趣小组同学分组在实验室设计用大理石和稀盐酸完成实验室制备二氧化碳并验证二氧化碳性质的实验,如图所示: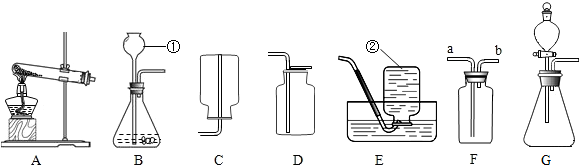
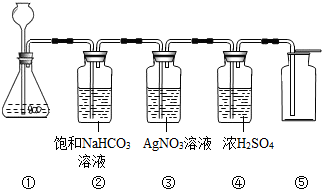 在实验室中,同学们用如图装置制取纯净干燥的CO2.
在实验室中,同学们用如图装置制取纯净干燥的CO2.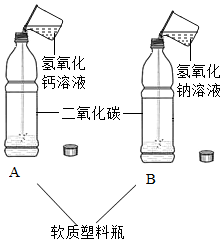 实验室在做有关CO2的性质实验中,用氢氧化钠溶液吸收CO2,而不用澄清石灰水,小喵同学想用以下A、B两组对比试验进行验证(实验后立即盖紧瓶盖并振荡);
实验室在做有关CO2的性质实验中,用氢氧化钠溶液吸收CO2,而不用澄清石灰水,小喵同学想用以下A、B两组对比试验进行验证(实验后立即盖紧瓶盖并振荡);