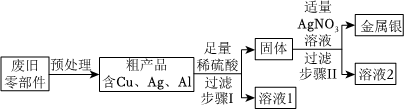
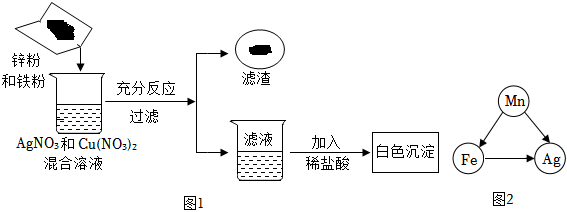
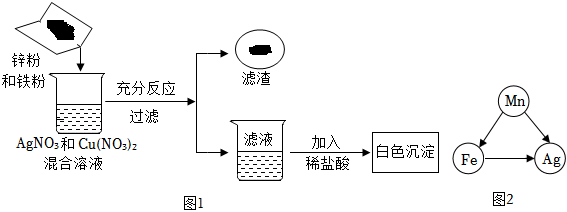
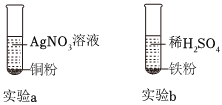
[考点]
金属的物理性质及用途,金属与氧气的反应,金属活动性强弱的判断,
[答案]
(1)常温下,铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化;
(2)2Al+6HCl═2AlCl3+3H2↑;
(3)铜、铁、铝;
(4)BC。
[解析]
解:(1)常温下,铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化,所以金属铝在常温下耐腐蚀;
(2)铝和铁在氢的前面,能与盐酸反应,铝与盐酸反应生成氯化铝和氢气,化学方程式为:2Al+6HCl═2AlCl3+3H2↑,铁和盐酸反应生成氯化亚铁浅绿色溶液和氢气;
(3)人类大量使用铁、铝、铜这三种金属的先后顺序是铜、铁、铝;因为铜的活动性较弱,容易被人类发现和冶炼;铁的活动性适中,在人类掌握了炼铁技术后开始大量使用;铝的活动性强,冶炼困难,直到近代电解铝技术发展后才被大量使用。
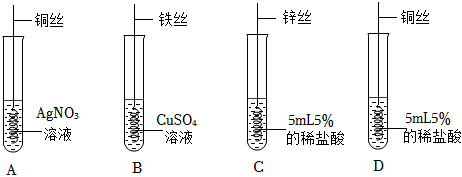
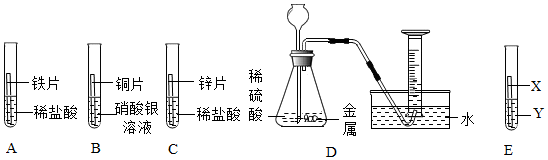
(4)A、将铁丝分别放入盛有硝酸铝溶液和硫酸铜溶液的两支试管中,铁与硝酸铝不反应,证明铁的活动性弱于铝,铁与硫酸铜反应,证明铁的活动性强于铜,故正确;
B、将粗细相同的铁丝、铜丝分别放入盛有硫酸铝溶液的两支试管中,铁丝、铜丝都不与硫酸铝反应,能证明铝的活动性强于铁和铜,不能证明铁和铜的活动性顺序,故错误;
C、将铝片、铁片分别放入盛有硫酸铜溶液的两支试管中,铝片、铁片都与硫酸铜反应,能证明铝和铁的活动性强于铜,不能证明铁和铝的活动性顺序,故错误;
D、将粗铝丝、薄铜片分别放入盛有硝酸亚铁溶液的两支试管中,铝能与硫酸亚铁反应,证明铝的活动性强于铁,铜不与硫酸亚铁反应,证明铁的活动性强于铜,故正确。
故答案为:(1)常温下,铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化;
(2)2Al+6HCl═2AlCl3+3H2↑;
(3)铜、铁、铝;
(4)BC。
[点评]
本题考查了"金属的物理性质及用途,金属与氧气的反应,金属活动性强弱的判断,",属于"典型题",熟悉题型是解题的关键。
 三星堆是中华文明的瑰宝,出土了大量的青铜器文物。回答下列问题:
三星堆是中华文明的瑰宝,出土了大量的青铜器文物。回答下列问题: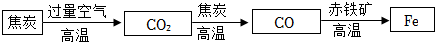
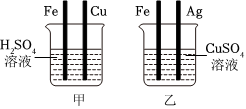
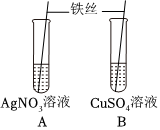 铁是生活中常见的金属,某同学用打磨过的铁丝进行如图实验。
铁是生活中常见的金属,某同学用打磨过的铁丝进行如图实验。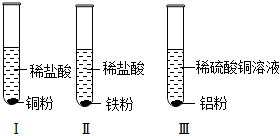
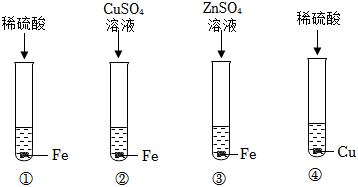
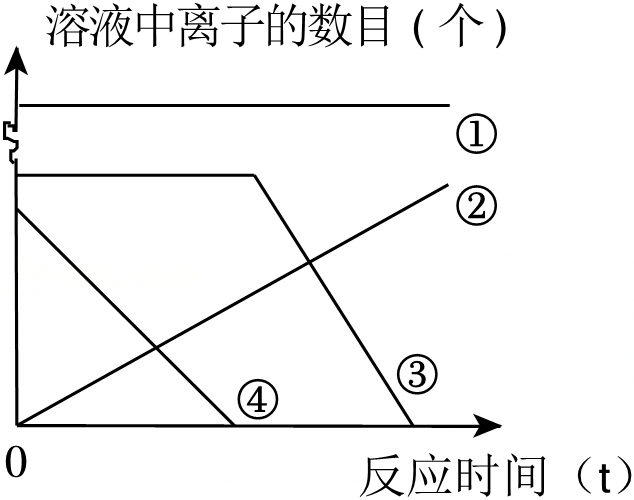
 根据金属的性质回答下列问题。
根据金属的性质回答下列问题。