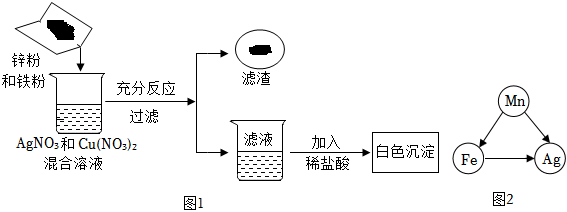
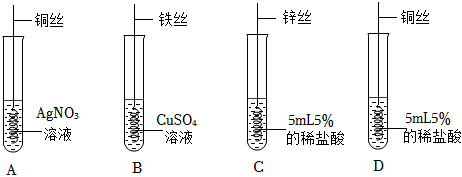
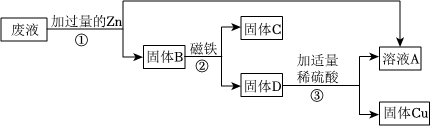
[解析]
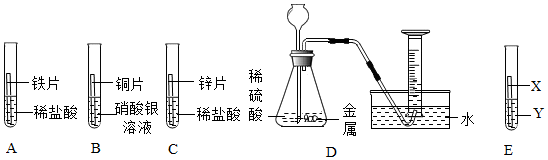
解:(1)A试管中铜与硝酸银溶液反应生成银和硝酸铜,硝酸铜溶液为蓝色溶液,化学方程式为Cu+2AgNO3=Cu(NO3)2+2Ag。
(2)A试管中铜与硝酸银溶液反应生成银和硝酸铜,说明铜的活动性大于银;B试管中铁与硫酸铜溶液反应生成铜和硫酸亚铁,说明铁的活动性大于铜;C试管中锌与稀盐酸反应生成氯化锌和氢气,说明锌的活动性位于氢前;D试管中铜和稀盐酸不反应,说明铜的活动性为于氢后,上述实验无法比较铁、锌的活动性,所以为验证四种金属活动性强弱,可补充的一个实验是将锌丝放入硫酸亚铁溶液,可比较铁、锌的活动性,故选B。
(3)将A和D反应后的溶液倒入同一个废液缸中,立即产生白色沉淀。说明盐酸与硝酸银反应生成氯化银白色沉淀和硝酸,即A试管中硝酸银溶液有剩余,同时铜与硝酸银反应生成银和硝酸铜溶液,所以A试管中既有剩余的硝酸银溶液又有生成的硝酸铜溶液,所以A反应后的溶液中一定含有的溶质是硝酸铜和硝酸银。
故答案为:(1)Cu+2AgNO3=Cu(NO3)2+2Ag;
(2)B;
(3)AgNO3。
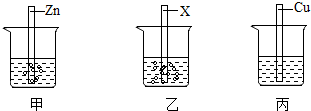
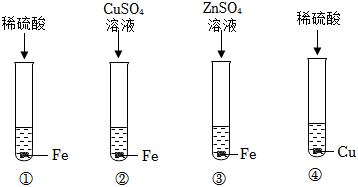
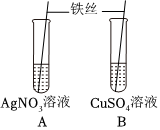 铁是生活中常见的金属,某同学用打磨过的铁丝进行如图实验。
铁是生活中常见的金属,某同学用打磨过的铁丝进行如图实验。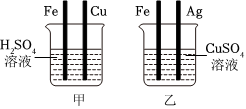

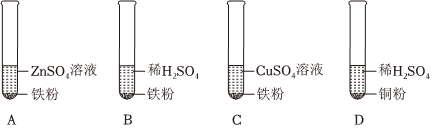
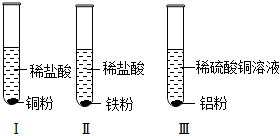
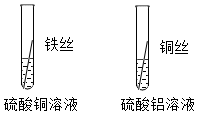 铁、铜、铝是生活中最常用的三种金属,小圆同学选取实验室提供的铁、铜、铝、稀硫酸、硫酸铜溶液、硫酸铝溶液,做了以下实验:
铁、铜、铝是生活中最常用的三种金属,小圆同学选取实验室提供的铁、铜、铝、稀硫酸、硫酸铜溶液、硫酸铝溶液,做了以下实验: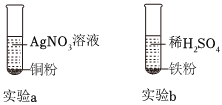 三星堆是中华文明的瑰宝,出土了大量的青铜器文物。回答下列问题:
三星堆是中华文明的瑰宝,出土了大量的青铜器文物。回答下列问题: