[考点]
金属与盐溶液反应的原理,金属活动性强弱的判断,
[答案]
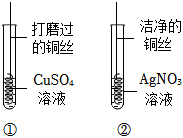
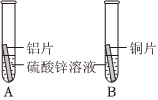
(1)铝丝表面生成红色物质,蓝色溶液逐渐变浅(合理即可);
(2)Cu+2AgNO3=Cu(NO3)2+2Ag;
(3)Al2(SO4)3、ZnSO4;
(4)可能有。
[解析]
解:(1)铝和硫酸铜溶液反应生成铜和硫酸铝,反应的现象为:铝丝表面生成红色物质,溶液的蓝色逐渐变浅;
(2)铜和硝酸银反应生成银和硝酸铜,反应的化学方程式是:Cu+2AgNO3 = Cu(NO3)2+2Ag;
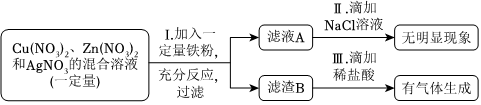
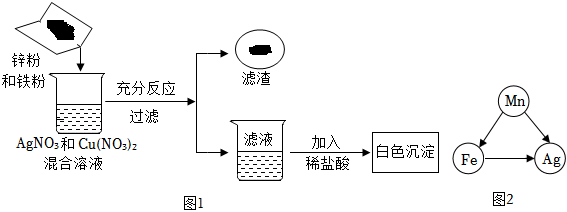
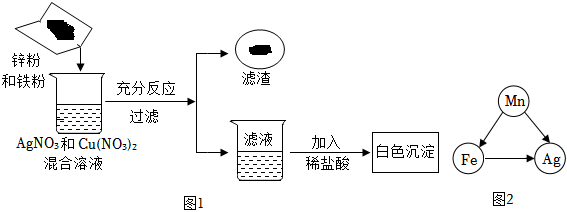
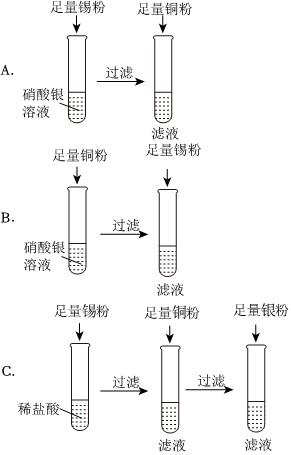
(3)金属活动性Al>Zn>H>Cu,则向一定质量的CuSO4溶液中,加入一定质量的铝粉和锌粉的混合物,铝能与硫酸铜反应生成硫酸铝与铜,锌能与硫酸铜反应生成硫酸锌与铜,根据化学反应方程式分析可知2Al+3CuSO4=Al2(SO4)3+3Cu、Zn+CuSO4=ZnSO4+Cu,54份质量的铝完全反应后生成192份质量的铜,则反应后溶液的质量减小;65份质量的锌完全反应后生成64份质量的铜,则反应后溶液的质量增加,实验中充分反应后过滤,所得滤液的质量等于原混合溶液的质量,则说明两个反应均发生,溶液中一定含有Al2(SO4)3、ZnSO4;
(4)根据上述分析可知Zn、Al均参与化学反应,金属活动性Al>Zn,则Al完全反应完,若Zn反应后有剩余,则Zn能与稀盐酸反应生成H2,故向滤渣上滴加盐酸可能有气泡产生。
故答案为:(1)铝丝表面生成红色物质,蓝色溶液逐渐变浅(合理即可);
(2)Cu+2AgNO3 = Cu(NO3)2+2Ag;
(3)Al2(SO4)3、ZnSO4;
(4)可能有。
[点评]
本题考查了"金属与盐溶液反应的原理,金属活动性强弱的判断,",属于"必考题",熟悉题型是解题的关键。
 根据金属的性质回答下列问题。
根据金属的性质回答下列问题。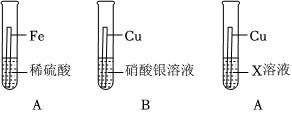
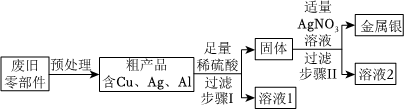
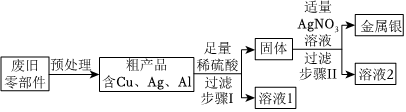
 C919大飞机是我国自行研制、具有自主知识产权的大型喷气式民用飞机。
C919大飞机是我国自行研制、具有自主知识产权的大型喷气式民用飞机。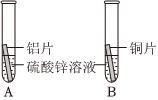 C919大飞机是我国自行研制、具有自主知识产权的大型喷气式民用飞机。
C919大飞机是我国自行研制、具有自主知识产权的大型喷气式民用飞机。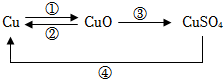
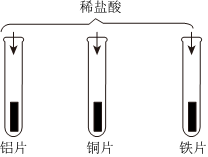 “神舟飞天”、“高铁奔驰”等中国制造,展现了中国智慧,增强了中华民族的自信心和自豪感,根据所学知识回答问题。
“神舟飞天”、“高铁奔驰”等中国制造,展现了中国智慧,增强了中华民族的自信心和自豪感,根据所学知识回答问题。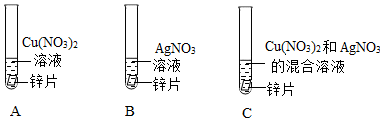
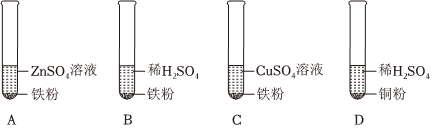
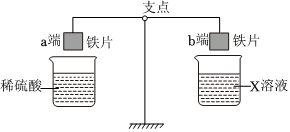 人类文明的发展和社会的进步与金属材料的关系十分密切。如图是有关金属的实验,实验前等臂杠杆两端悬挂等高度、等规格、等质量的铁片。请结合金属的相关知识分析以下问题。
人类文明的发展和社会的进步与金属材料的关系十分密切。如图是有关金属的实验,实验前等臂杠杆两端悬挂等高度、等规格、等质量的铁片。请结合金属的相关知识分析以下问题。