[解析]
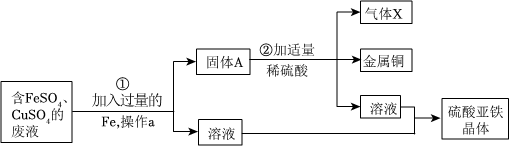
解:(1)实验目的是某工厂以含有FeSO4和少量H2SO4的废水为原料来制备FeSO4•7H2O,调节废水pH时,适宜加入铁,铁能与硫酸反应生成硫酸亚铁和氢气,不会生成新的杂质。
(2)上述三种试剂中有一种也经常用来调节废水pH,该物质是氢氧化钙,可在该生产过程中不能使用,是因为若使用氢氧化钙,会生成新的杂质硫酸钙。
(3)结晶池底部有一定坡度,使结晶出来的晶体能够集中在一起,便于收集晶体。
(4)由于FeSO4•7H2O晶体易溶于水,所以在洗涤的时候用冰水洗涤FeSO4•7H2O晶体减少晶体因溶解而损失。由于FeSO4•7H2O晶体受热容易失去结晶水,所以采取低温干燥,防止受热晶体失去结晶水。
(5)FeSO4溶解度大约在64℃左右达到最大,由硫酸亚铁溶液中结晶出FeSO4•4H2O的实验方案:蒸发浓缩,控制温度在64℃以下结晶、过滤、洗涤、干燥。
故答案为:
(1)A;
(2)若使用氢氧化钙,会生成新的杂质硫酸钙;
(3)便于收集晶体;
(4)减少晶体因溶解而损失;防止受热晶体失去结晶水;
(5)控制温度在64℃以下结晶。