服务热线
搜题▪组卷
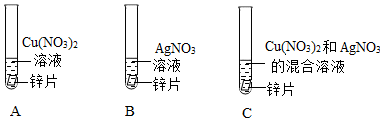
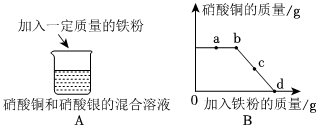
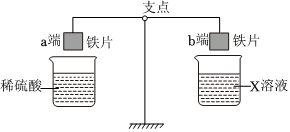 人类文明的发展和社会的进步与金属材料的关系十分密切。如图是有关金属的实验,实验前等臂杠杆两端悬挂等高度、等规格、等质量的铁片。请结合金属的相关知识分析以下问题。
人类文明的发展和社会的进步与金属材料的关系十分密切。如图是有关金属的实验,实验前等臂杠杆两端悬挂等高度、等规格、等质量的铁片。请结合金属的相关知识分析以下问题。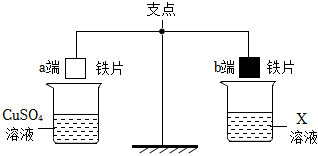 人类文明的发展和社会的进步与金属材料的关系十分密切。如图是有关金属的实验,请结合金属的相关知识分析以下问题。
人类文明的发展和社会的进步与金属材料的关系十分密切。如图是有关金属的实验,请结合金属的相关知识分析以下问题。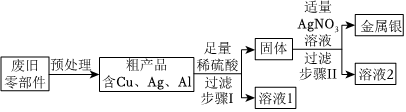
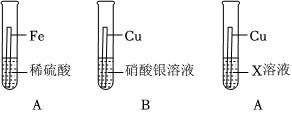
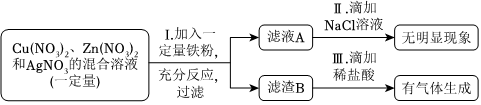
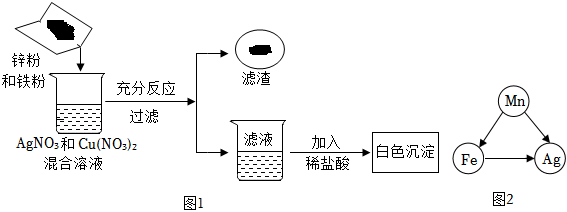
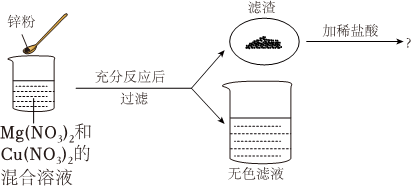 (1)将一定质量的Zn粉加入Mg(NO3)2和Cu(NO3)2的混合溶液中,发生反应的化学方程式为 。
(1)将一定质量的Zn粉加入Mg(NO3)2和Cu(NO3)2的混合溶液中,发生反应的化学方程式为 。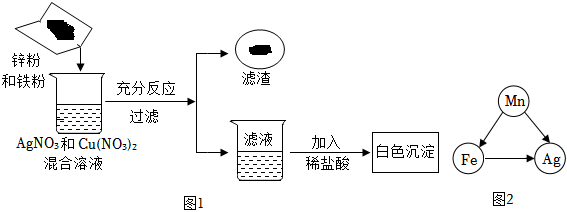
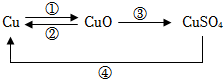
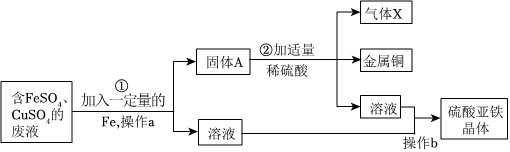
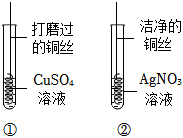 根据金属的性质回答下列问题。
根据金属的性质回答下列问题。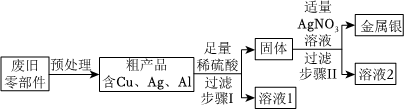

jp@dyw.com
2025-04-07
初中化学 | | 填空题