服务热线
搜题▪组卷
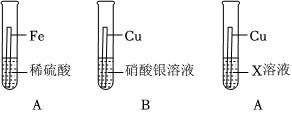
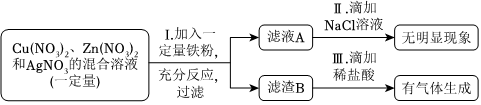
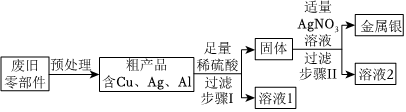
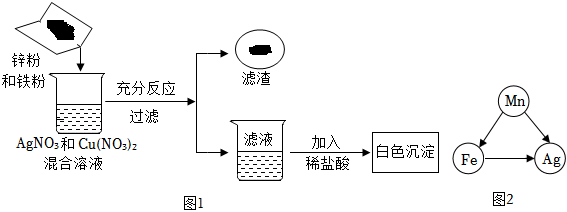
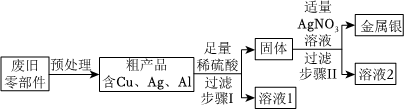
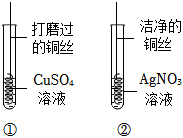 根据金属的性质回答下列问题。
根据金属的性质回答下列问题。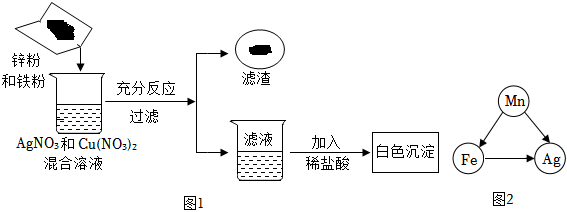
 C919大飞机是我国自行研制、具有自主知识产权的大型喷气式民用飞机。
C919大飞机是我国自行研制、具有自主知识产权的大型喷气式民用飞机。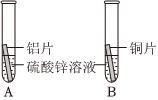 C919大飞机是我国自行研制、具有自主知识产权的大型喷气式民用飞机。
C919大飞机是我国自行研制、具有自主知识产权的大型喷气式民用飞机。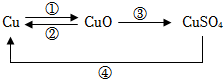
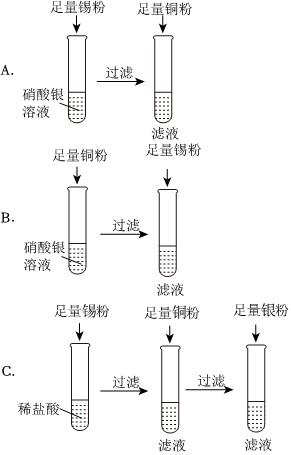
 “神舟飞天”、“高铁奔驰”等中国制造,展现了中国智慧,增强了中华民族的自信心和自豪感,根据所学知识回答问题。
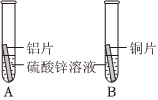
“神舟飞天”、“高铁奔驰”等中国制造,展现了中国智慧,增强了中华民族的自信心和自豪感,根据所学知识回答问题。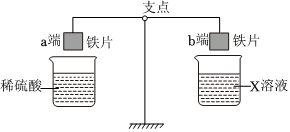 人类文明的发展和社会的进步与金属材料的关系十分密切。如图是有关金属的实验,实验前等臂杠杆两端悬挂等高度、等规格、等质量的铁片。请结合金属的相关知识分析以下问题。
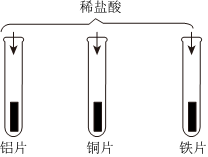
人类文明的发展和社会的进步与金属材料的关系十分密切。如图是有关金属的实验,实验前等臂杠杆两端悬挂等高度、等规格、等质量的铁片。请结合金属的相关知识分析以下问题。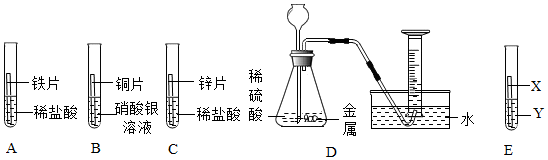
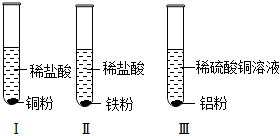
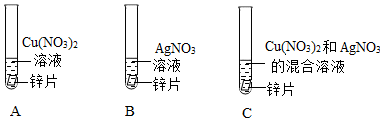

gr@dyw.com
2025-05-06
初中化学 | | 填空题