服务热线
搜题▪组卷
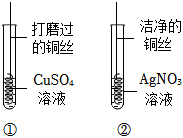 根据金属的性质回答下列问题。
根据金属的性质回答下列问题。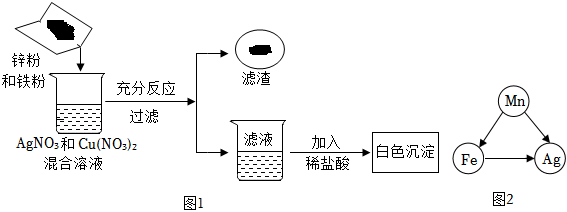
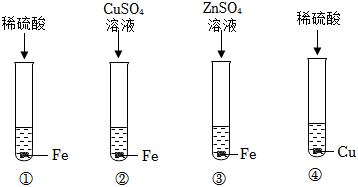
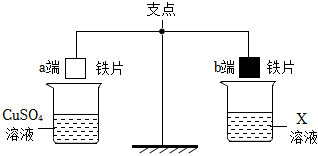 人类文明的发展和社会的进步与金属材料的关系十分密切。如图是有关金属的实验,请结合金属的相关知识分析以下问题。
人类文明的发展和社会的进步与金属材料的关系十分密切。如图是有关金属的实验,请结合金属的相关知识分析以下问题。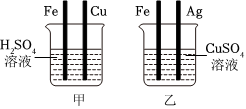
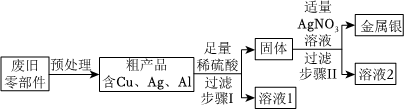
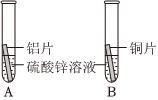 C919大飞机是我国自行研制、具有自主知识产权的大型喷气式民用飞机。
C919大飞机是我国自行研制、具有自主知识产权的大型喷气式民用飞机。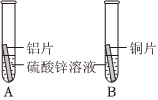 C919大飞机是我国自行研制、具有自主知识产权的大型喷气式民用飞机。
C919大飞机是我国自行研制、具有自主知识产权的大型喷气式民用飞机。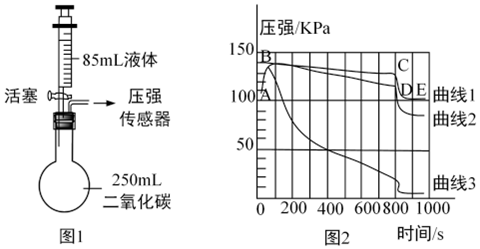
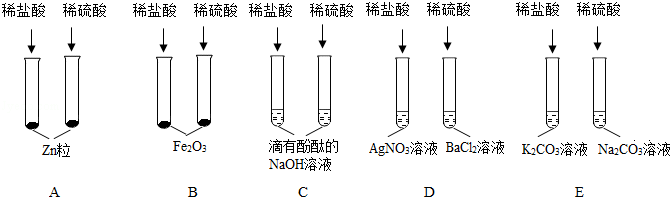
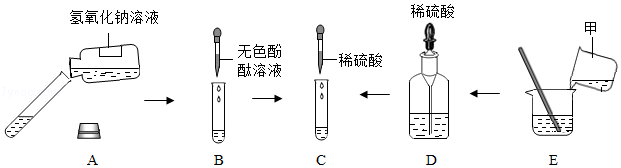
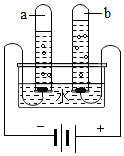 在宏观、微观和符号之间建立联系是化学特有的思维方式。根据电解水的实验,回答下列问题。
在宏观、微观和符号之间建立联系是化学特有的思维方式。根据电解水的实验,回答下列问题。
gph@dyw.com
2025-05-24
初中化学 | | 填空题