[考点]
饱和溶液和不饱和溶液,有关溶质质量分数的简单计算,物质的相互转化和制备,反应类型的判定,
[答案]
(1)不饱和。
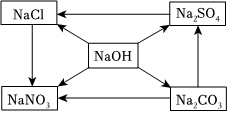
(2BaCl2+Na2SO4═BaSO4↓+2NaCl。
(3)①复分解反应。
②氢氧化钠。
[解析]
解:(1)50g“果蔬洗盐”中碳酸氢钠质量是:50g×15%=7.5g,20℃碳酸氢钠的溶解度为9.6g,该温度下,100g水中溶解9.6g恰好饱和,7.5g碳酸氢钠溶解于100g水中形成不饱和溶液。
故答案为:不饱和。
(2)硫酸钠可用于钡盐(如氯化钡)中毒的解毒剂,解毒原理是氯化钡能和硫酸钠反应生成白色沉淀硫酸钡和氯化钠,把钡离子转化成沉淀,从而防止钡离子引起中毒,反应的化学方程式为BaCl2+Na2SO4═BaSO4↓+2NaCl。
故答案为:BaCl2+Na2SO4═BaSO4↓+2NaCl。
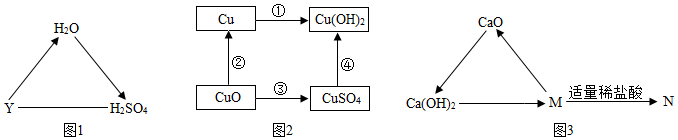
(3)①NaCl→NaNO3的转化反应,应该是氯化钠和硝酸银反应生成白色沉淀氯化银和硝酸钠,该反应是两种化合物相互交换成分,生成另外两种新的化合物,属于复分解反应。
故答案为:复分解反应。
②氢氧化钠既能与Na2CO3发生双向转化,又能与Na2SO4发生双向转化,例如氢氧化钠和二氧化碳反应生成碳酸钠和水,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,氢氧化钠和稀硫酸反应生成硫酸钠和水,硫酸钠和氢氧化钡反应生成白色沉淀硫酸钡和氢氧化钠,因此该物质是氢氧化钠。
故答案为:氢氧化钠。
[点评]
本题考查了"饱和溶液和不饱和溶液,有关溶质质量分数的简单计算,物质的相互转化和制备,反应类型的判定,",属于"综合题",熟悉题型是解题的关键。