[考点]
金属的化学性质,物质的相互转化和制备,反应类型的判定,
[答案]
(1)玻璃棒;
(2)Fe、Cu;
(3)Fe+H2SO4=FeSO4+H2↑;置换反应;
(4)BCD。
[解析]
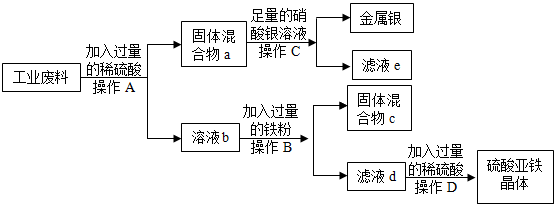
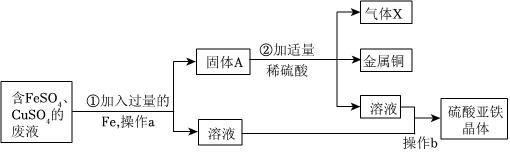
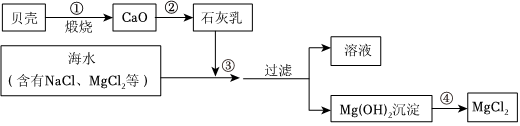
解:(1)通过过滤可将难溶于水的固体物质与水分离,操作a的名称是过滤,该操作中用到的玻璃仪器有烧杯、漏斗、玻璃棒;
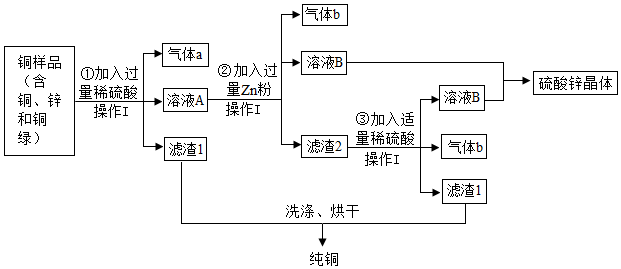
(2)金属活动性顺序中,排在前面的金属能将排在后面的金属从其化合物的水溶液中置换出来,因为①加入过量的Fe,发生化学反应:Fe+CuSO4=Cu+FeSO4,所以固体A的成分为剩余的Fe、Cu;
(3)根据分析,生成气体X的化学方程式是Fe+H2SO4=FeSO4+H2↑,属于置换反应;
(4)参与反应的三种金属元素中,银的活动性最差,铜其次,锌最强,锌最先与硝酸银反应生成硝酸锌和银,待硝酸银耗尽,若锌粉还有剩余,再继续与硝酸铜反应,滤液仍为蓝色,说明原废液中的硝酸铜还有剩余,则滤渣中一定不含锌,一定有银,可能有铜;
A、根据分析,将滤渣加入稀盐酸中银和铜都不会和盐酸反应,不会产生气泡,故A错误;
B、根据分析,滤液中一定含有硝酸铜和硝酸锌,故B正确;
C、根据分析,滤液中一定含有硝酸铜和硝酸锌,若锌的质量与废液中的硝酸银恰好完全反应,则滤液中不含硝酸银,若锌未将硝酸银耗尽,则滤液中含有硝酸银,故滤液中可能含有硝酸银,可以向滤液中滴加NaCl溶液检验硝酸银的存在,产生白色沉淀,则存在硝酸银,反之则不存在,故C正确;
D、根据分析,滤液中一定含有硝酸铜和硝酸锌,将滤液加入盛有NaOH溶液的烧杯中,硝酸铜和氢氧化钠反应生成蓝色沉淀氢氧化铜和硝酸钠,消耗了氢氧化钠,碱性减弱,故反应后烧杯中溶液的pH会减小,故D正确;
故选BCD。
故答案为:
(1)玻璃棒;
(2)Fe、Cu;
(3)Fe+H2SO4=FeSO4+H2↑;置换反应;
(4)BCD。
[点评]
本题考查了"金属的化学性质,物质的相互转化和制备,反应类型的判定,",属于"典型题",熟悉题型是解题的关键。
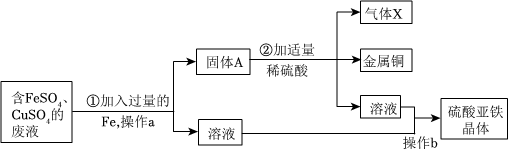
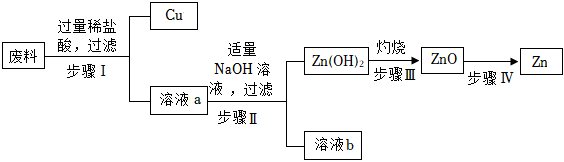
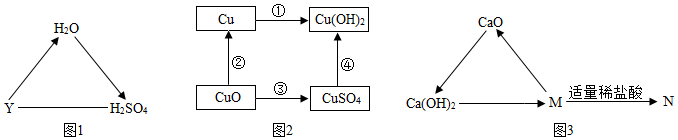
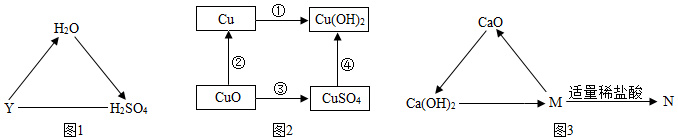
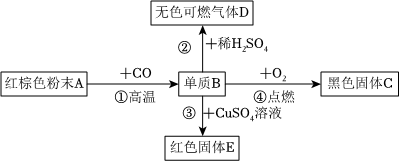
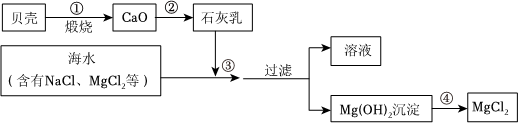
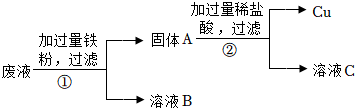 生产线路板的废液中含有FeCl3、FeCl2、CuCl2。化学兴趣小组的同学在实验室利用如图所示流程进行从废液中回收金属铜的实验。(已知:2FeCl3+Fe=3FeCl2)
生产线路板的废液中含有FeCl3、FeCl2、CuCl2。化学兴趣小组的同学在实验室利用如图所示流程进行从废液中回收金属铜的实验。(已知:2FeCl3+Fe=3FeCl2)