服务热线
搜题▪组卷
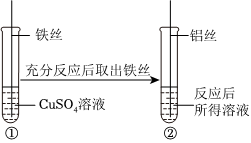
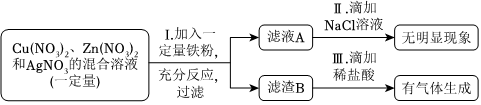
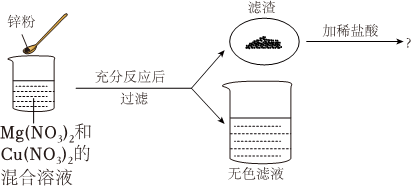 (1)将一定质量的Zn粉加入Mg(NO3)2和Cu(NO3)2的混合溶液中,发生反应的化学方程式为 。
(1)将一定质量的Zn粉加入Mg(NO3)2和Cu(NO3)2的混合溶液中,发生反应的化学方程式为 。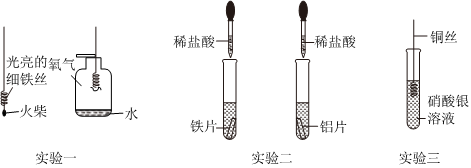
| 实验 | 操作步骤 | 实验现象 | 实验结论 |
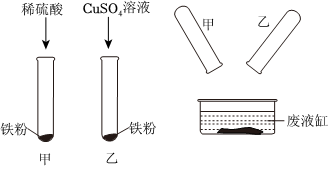
| 1 | 切开蜡烛,取出打火石,用砂纸打磨。 | 打火石是银白色 | 该金属一定不是 |
| 2 | 取少量打磨后的打火石加入试管中,滴加盐酸。 | 该金属一定不是铁 | |
| 3 | 取少量打磨后的打火石加入试管中,滴加硫酸铜溶液。 | 有 色物质析出。 | 该金属一定是镁 |
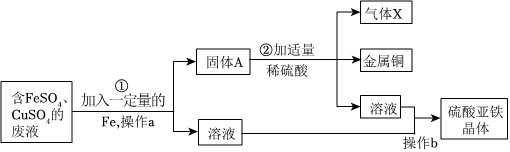
 全世界每年因生锈损失的钢铁,约占世界年产量的四分之一.某学生想探究铁生锈的条件,他将干净的铁钉放入A、B、C三支试管中,分别进行如图所示实验.
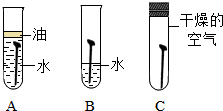
全世界每年因生锈损失的钢铁,约占世界年产量的四分之一.某学生想探究铁生锈的条件,他将干净的铁钉放入A、B、C三支试管中,分别进行如图所示实验.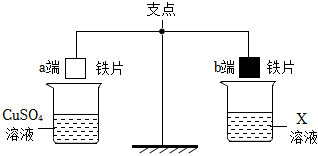 人类文明的发展和社会的进步与金属材料的关系十分密切。如图是有关金属的实验,请结合金属的相关知识分析以下问题。
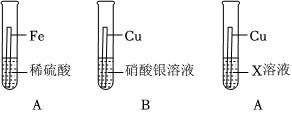
人类文明的发展和社会的进步与金属材料的关系十分密切。如图是有关金属的实验,请结合金属的相关知识分析以下问题。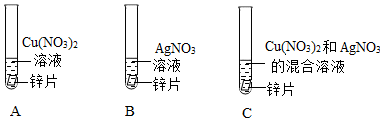
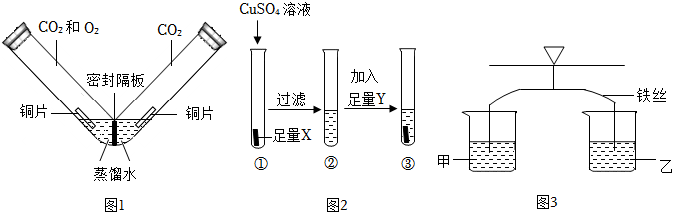
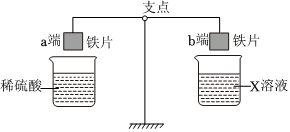 人类文明的发展和社会的进步与金属材料的关系十分密切。如图是有关金属的实验,实验前等臂杠杆两端悬挂等高度、等规格、等质量的铁片。请结合金属的相关知识分析以下问题。
人类文明的发展和社会的进步与金属材料的关系十分密切。如图是有关金属的实验,实验前等臂杠杆两端悬挂等高度、等规格、等质量的铁片。请结合金属的相关知识分析以下问题。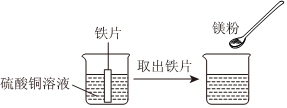


jp@dyw.com
2025-03-30
初中化学 | | 填空题