[考点]
金属与盐溶液反应的原理,金属活动性顺序及其应用,金属锈蚀的条件及其防护,化学变化和物理变化的判别,
[答案]
(1)③;
(2)隔绝氧气和水;
(3)能;2Al+3FeSO4=Al2(SO4)3+3Fe。
[解析]
解:(1)①金属活动性:铝>铁>铜,由图可知,铜使用的最早,其次是铁,铝使用的最晚,则金属使用的年代越早,金属活动性越弱,不符合题意;
②金属活动性:铝>铁>铜,铝比铁活泼,但是铝能与空气中的氧气反应,在其表面形成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化,而铁锈疏松多孔,具有吸附性,会加速铁的锈蚀,铝更耐腐蚀,不符合题意;
③常见的不锈钢、黄铜、硬铝等合金的形成过程是由各组分熔合成均匀的液体,再经冷凝而得,无新物质生成,属于物理变化,符合题意;
④铁锈疏松多孔,具有吸附性,会加速铁的锈蚀,故铁制品表面的氧化物需要除去,而铝制品表面的氧化铝薄膜结构致密,可以阻止铝进一步被氧化,用钢丝球多次刷洗,会除去这一层氧化膜,缩短铝制品的使用寿命,不符合题意;
故选③;
(2)铁生锈的条件是与氧气和水同时接触,喷漆、涂油等方式可以在金属表面形成一层保护膜,将金属与氧气和水隔绝,从而达到防锈的目的;
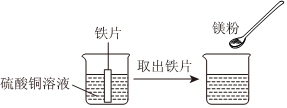
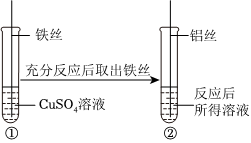
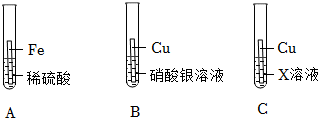
(3)试管①中铁和硫酸铜反应生成硫酸亚铁和铜,有红色固体析出,说明铁比铜活泼,取出铁丝,插入铝丝,铝与硫酸亚铁反应生成硫酸铝和铁,溶液变为无色,说明铝比铁活泼,能证明三种金属的活动性顺序;
试管①中反应后溶液中一定含硫酸亚铁,插入铝丝,铝一定与硫酸亚铁反应生成硫酸铝和铁,该反应的化学方程式为:2Al+3FeSO4=Al2(SO4)3+3Fe。
故答案为:(1)③;
(2)隔绝氧气和水;
(3)能;2Al+3FeSO4=Al2(SO4)3+3Fe。
[点评]
本题考查了"金属与盐溶液反应的原理,金属活动性顺序及其应用,金属锈蚀的条件及其防护,化学变化和物理变化的判别,",属于"综合题",熟悉题型是解题的关键。

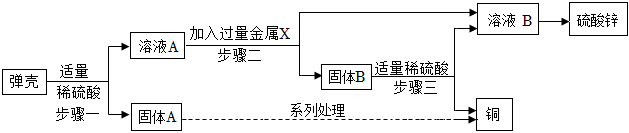
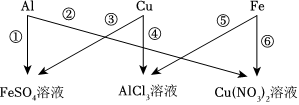 为验证铝、铜、铁的金属活动性顺序,同学们设计了如图所示的6个实验(“→”表示将金属丝加入盐溶液中)。
为验证铝、铜、铁的金属活动性顺序,同学们设计了如图所示的6个实验(“→”表示将金属丝加入盐溶液中)。 人类文明的发展和社会的进步与金属材料的关系十分密切。如图是有关金属的实验,请结合金属的相关知识分析以下问题。
人类文明的发展和社会的进步与金属材料的关系十分密切。如图是有关金属的实验,请结合金属的相关知识分析以下问题。

 ?
? ?
? ?
? ?
?