[考点]
金属的化学性质,金属活动性顺序及其应用,书写化学方程式、文字表达式、电离方程式,
[答案]
(1)弱;
(2)Cu或铜;Zn+H2SO4═ZnSO4+H2↑或Zn+NiSO4═Ni+ZnSO4;
(3)B。
[解析]
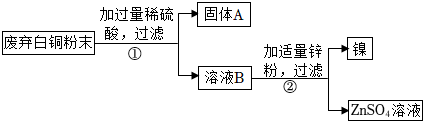
解:(1)分析实验现象可知,向盛有等量镍粉和锌粉的两支试管中分别加入溶质质量分数相同的稀硫酸,观察到都有气泡产生,且锌粉与稀硫酸反应更剧烈,则两种金属的活动性强弱是Zn>Ni,即镍的金属活动性比锌弱;故答案为:弱;
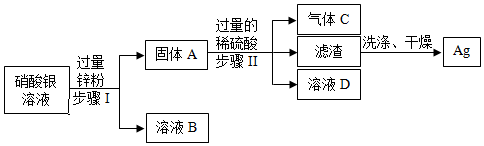
(2)根据金属活动性顺序,铜排在氢的后面,与酸不反应,因此固体A为铜;Ni+H2SO4═NiSO4+H2↑,硫酸过量,因此滤液B中含有硫酸和硫酸镍,锌与硫酸反应生成硫酸锌和氢气,化学方程式为:Zn+H2SO4═ZnSO4+H2↑,锌比镍活泼,可以将镍置换出来,锌与硫酸镍反应生成硫酸锌和镍,化学方程式为:Zn+NiSO4═Ni+ZnSO4;故答案为:Cu或铜;Zn+H2SO4═ZnSO4+H2↑或Zn+NiSO4═Ni+ZnSO4;
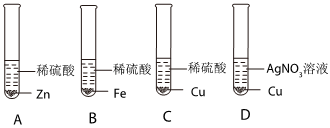
(3)A、锌和稀盐酸反应速率比镍快,说明锌比镍活泼,铜不能和稀盐酸反应,说明活动性锌>镍>铜,该选项能够达到实验目的;
B、镍、铜都不能和硫酸锌反应,说明锌最活泼,不能比较镍和铜的活泼性,该选项不能达到实验目的;
C、锌能和硫酸镍反应,说明锌比镍活泼,铜不能和硫酸镍反应,说明活动性锌>镍>铜,该选项能够达到实验目的;
D、镍不能和硫酸锌反应,说明锌比镍活泼,镍能和硫酸铜反应,说明镍比铜活泼,该选项能够达到实验目的;
故选:B。
[点评]
本题考查了"金属的化学性质,金属活动性顺序及其应用,书写化学方程式、文字表达式、电离方程式,",属于"难典题",熟悉题型是解题的关键。