[解析]
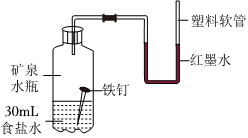
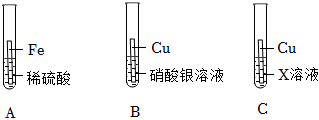
解:(1)如图所示,将等质量锌片、铁片放于甲、乙两试管中,反应结束后,固体均有剩余,说明酸不足,产生气体量相同,锌的相对原子质量为65,铁的相对原子质量为56,产生等量的氢气,消耗锌的质量比铁多,故甲、乙两试管所得溶液的质量甲>乙;
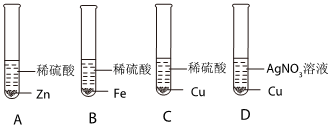
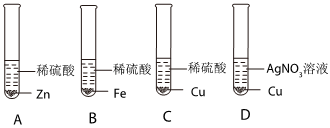
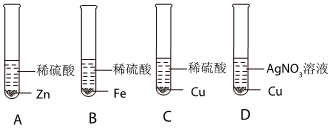
(2)甲实验说明锌的活动性位于氢之前,乙实验说明铁的活动性位于氢之前,丙实验说明铜的活动性位于银之前,只需验证铁和铜的活动性顺序即可,已知图丁中的溶液B为浅绿色溶液,为亚铁的盐溶液,故金属A应为Cu;
(3)铜和硝酸银反应生成银和硝酸铜,反应的方程式为Cu+2AgNO3=2Ag+Cu(NO3)2;
(4)四种金属活动性由强到弱的顺序为锌、铁、铜、银,故向反应后的丙试管中继续加入锌粉和铁粉的混合物,锌粉先与硝酸银反应,再与硝酸铜反应,若无法完全反应,铁粉再参与反应,已知得到无色滤液,说明已将铜离子置换完,且铁未参与反应,故该滤液中只含有硝酸锌,故含有的阳离子有Zn2+。
故答案为:
(1)>;
(2)Cu;
(3)Cu+2AgNO3=2Ag+Cu(NO3)2;
(4)Zn2+。


 ?
? ?
?
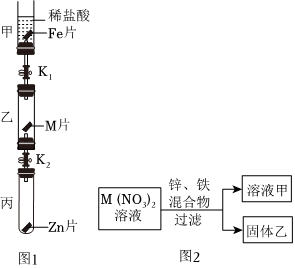

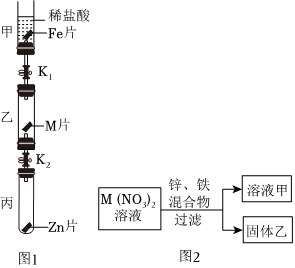
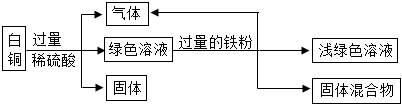
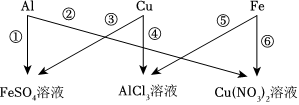 为验证铝、铜、铁的金属活动性顺序,同学们设计了如图所示的6个实验(“→”表示将金属丝加入盐溶液中)。
为验证铝、铜、铁的金属活动性顺序,同学们设计了如图所示的6个实验(“→”表示将金属丝加入盐溶液中)。