服务热线
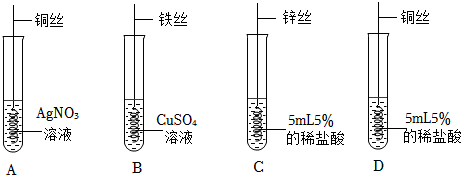
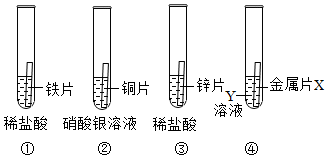
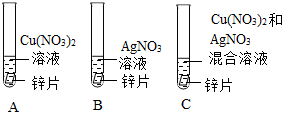 为探究铜、锌、银的金属活动性顺序,设计了如图所示的三个实验(金属均已打磨,其形状、大小相同;所用溶液溶质质量分数、用量也相同)。
为探究铜、锌、银的金属活动性顺序,设计了如图所示的三个实验(金属均已打磨,其形状、大小相同;所用溶液溶质质量分数、用量也相同)。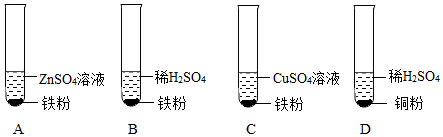
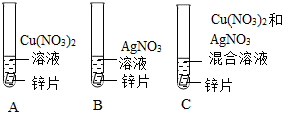 为探究铜、锌、银的金属活动性顺序,设计了如图所示的三个实验(金属均已打磨,其形状、大小相同;所用溶液溶质质量分数、用量也相同)。
为探究铜、锌、银的金属活动性顺序,设计了如图所示的三个实验(金属均已打磨,其形状、大小相同;所用溶液溶质质量分数、用量也相同)。
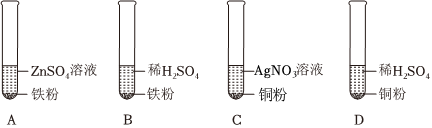
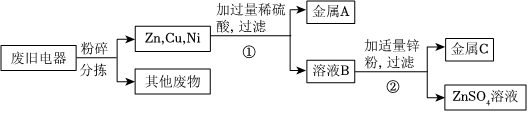
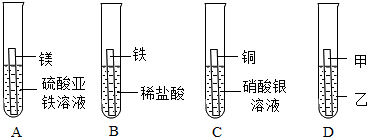
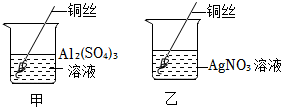 学习小组同学在探究Cu、Al、Ag的活动性顺序时,做了如图两个实验,并由此展开了一系列学习探究活动。
学习小组同学在探究Cu、Al、Ag的活动性顺序时,做了如图两个实验,并由此展开了一系列学习探究活动。| 序号 | 实验操作 | 实验现象 | 实验结论 |
| 实验1 | 取少量废液于试管中,加入氯化钠溶液 | 无明显现象 | 废液中没有AgNO3 |
| 实验2 | 取少量废液于试管中,加入氯化钡溶液 | 产生白色沉淀 | 废液中有AgNO3 |
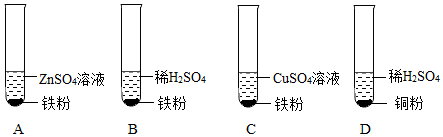
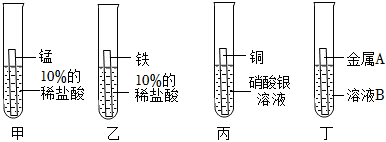
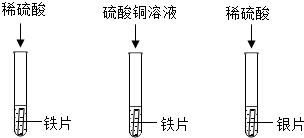
| 实验步骤 | 实验现象 | 解释与结论 |
| 取三支试管,分别向其中加入等质量、等浓度的稀硫酸,然后将大小、形状相同的锌、铜、镍三种金属片分别插入三支试管中。 | 锌片表面产生的气泡较快;镍片表面产生的气泡较慢;铜片无明显现象。 | 金属活动性顺序: 。 |
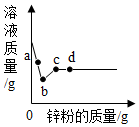

dyczhxyn
2023-03-20
初中化学 | | 填空题