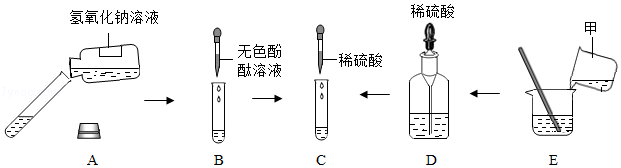
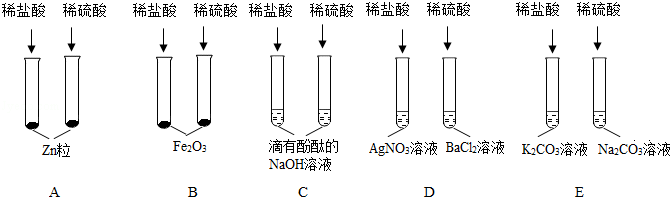
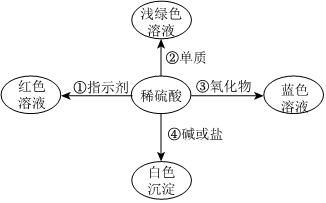
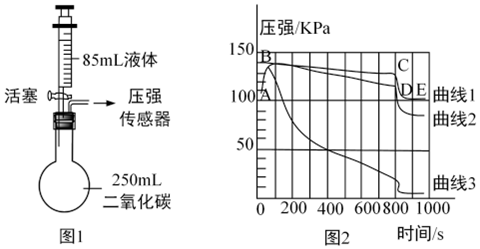
[解析]
解:(1)将一定量的镁粉和一枚打磨过的铁钉分别加入到溶质质量分数相同的等量稀盐酸中,由于两种金属的状态不同,镁粉与稀盐酸的接触面积大,反应速率快,故大家认为此结论不严谨.
(2)位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,铜的金属活动性比汞强,将打磨后的铜片加入到硝酸汞溶液中,生成硝酸铜溶液和汞,其反应的化学方程式为Cu+Hg(NO3)2═Cu(NO3)2+Hg;观察到的现象是铜片的表面覆盖一层银白色的金属.
(3)将实验①改进后,可以得出镁的金属活动性比铁强;由实验②可以得出铜的金属活动性比汞强;得出了四种金属的活动性顺序,还需通过实验得出铁的铜的金属活动性顺序,可将铁片加入到硫酸铜溶液中,铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜,可以得出铁的金属活动性比铜强,则A为铁,B为硫酸铜溶液(合理即可).
故答案为:(1)两种金属的状态不同,镁粉与稀盐酸的接触面积大,反应速率快;
(2)铜片的表面覆盖一层银白色的金属;Cu+Hg(NO3)2═Cu(NO3)2+Hg;
(3)Fe、CuSO4.
 在宏观、微观和符号之间建立联系是化学特有的思维方式。根据电解水的实验,回答下列问题。
在宏观、微观和符号之间建立联系是化学特有的思维方式。根据电解水的实验,回答下列问题。