[解析]
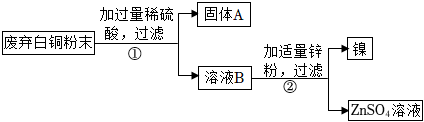
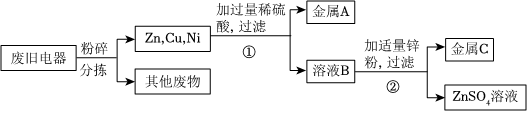
解:(1)向盛有等量镍粉和锌粉的两支试管中分别加入溶质质量分数相同的稀硫酸,观察到都有气泡产生,且锌粉与稀硫酸反应更剧烈,说明镍的金属活动性比锌弱;
(2)根据金属活动顺序,铜排在氢的后面,与酸不反应,因此固体A为铜,查阅资料可知,镍与稀硫酸反应的化学方程式为Ni+H2SO4═NiSO4+H2↑,溶液B中含有硫酸和硫酸镍,②中生成镍的反应是锌与硫酸镍反应生成镍和硫酸锌,反应的化学方程式为Zn+NiSO4═Ni+ZnSO4;
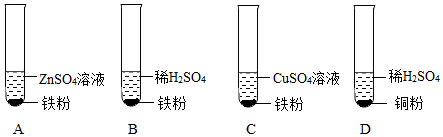
(3)A、Zn与稀盐酸反应比Ni更剧烈,说明金属活动性Zn>Ni,而Cu不与稀盐酸反应,能得出活动性Zn>Ni>Cu,故A不符合题意;
B、Ni和Cu都不能与ZnSO4溶液反应,说明锌的活动性最强,但无法证明Ni和Cu的活动性,故B符合题意;
C、Zn能与NiSO4溶液反应,说明锌的活动性大于镍,而铜不与硫酸镍溶液反应,说明铜的金属活动性小于镍,能证明活动性锌>镍>铜,故C不符合题意;
D、Ni不与ZnSO4溶液反应、说明活动性Zn>Ni,Ni能与CuSO4溶液反应,说明活动性Ni>Cu,能得出活动性Zn>Ni>Cu,故D不符合题意;
故选:B。
故答案为:(1)弱;
(2)Cu;Zn+NiSO4═Ni+ZnSO4;
(3)B。



 ?
?