[考点]
中和反应及其应用,溶液的酸碱性与pH的关系,
[答案]
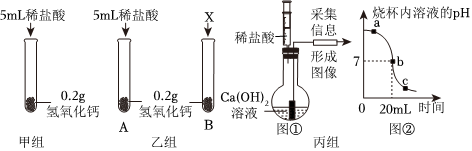
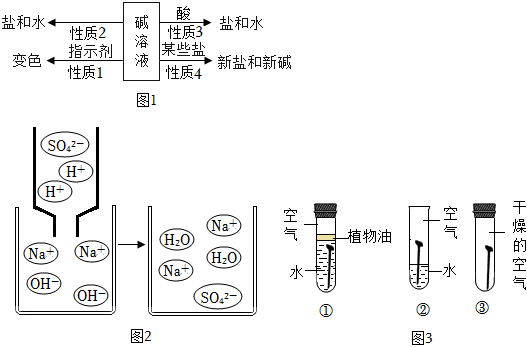
(1)白色固体溶解;
(2)5mL水;Ca(OH)2+2HCl=CaCl2+2H2O;
(3)Ca(OH)2、CaCl2。
[解析]
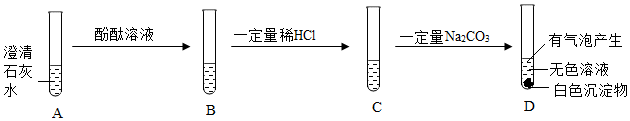
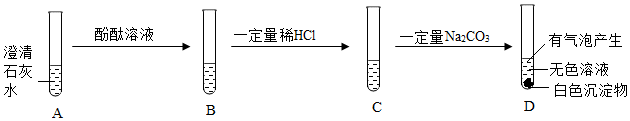
解:(1)氢氧化钙和稀盐酸反应生成氯化钙和水,会观察到白色固体溶解;但常温下氢氧化钙微溶于水,即使不反应,也可观察到固体溶解,故不能只根据固体完全溶解的现象来判断氢氧化钙与稀盐酸发生了反应。
(2)通过对比A、B两试管中固体溶解的情况得出氢氧化钙和盐酸能反应,A组为实验组,则B组为对照组,实验时应控制变量,可知B试管中应加入的试剂X为等量的5mL水,排除氢氧化钙溶于水的影响。氢氧化钙和盐酸反应生成氯化钙和水,反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O。
(3)a点时溶液的pH大于7,溶液显碱性,说明氢氧化钙有剩余,则a点对应的溶质有反应生成的CaCl2和过量的Ca(OH)2。
故答案为:
(1)白色固体溶解;
(2)5mL水;Ca(OH)2+2HCl=CaCl2+2H2O;
(3)Ca(OH)2、CaCl2。
[点评]
本题考查了"中和反应及其应用,溶液的酸碱性与pH的关系,",属于"易错题",熟悉题型是解题的关键。

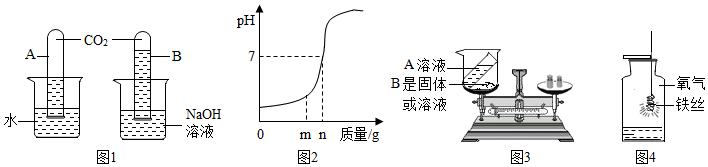
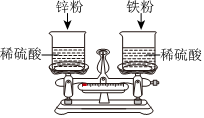 如图,托盘上各放一只等质量的烧杯,分别盛有等质量、等质量分数的稀硫酸,天平平衡,再向烧杯中分别加入等质量的铁粉和锌粉。
如图,托盘上各放一只等质量的烧杯,分别盛有等质量、等质量分数的稀硫酸,天平平衡,再向烧杯中分别加入等质量的铁粉和锌粉。