[解析]
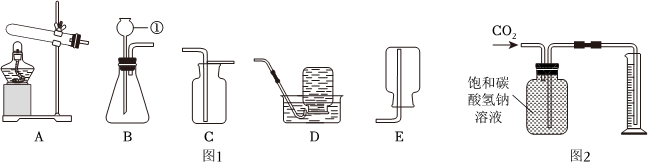
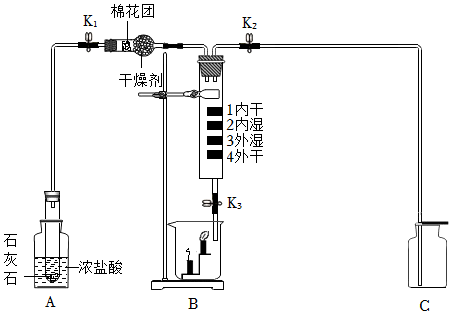
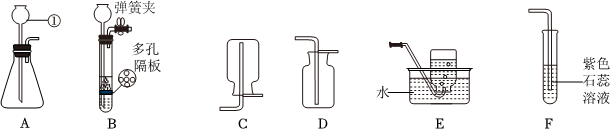
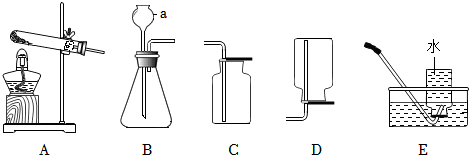
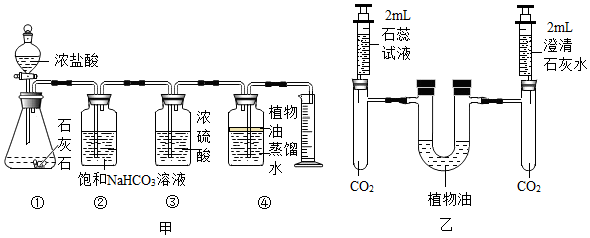
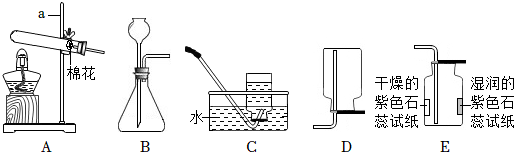
解:(1)由图可知,仪器①的名称是长颈漏斗;
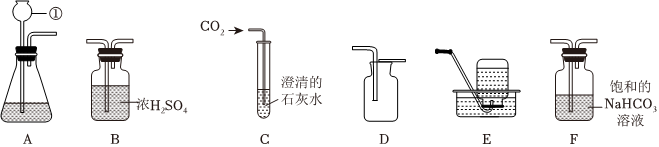
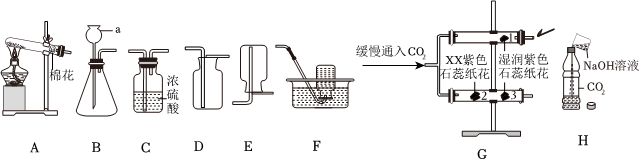
(2)实验室制取二氧化碳选用大理石或石灰石和稀盐酸,由于大理石或石灰石是固体,稀盐酸为液体,反应条件不需要加热,则发生装置应选B,二氧化碳的密度比空气大,能溶于水,一般只采用C向上排空气法收集,故用于实验室制备CO2的发生装置和收集装置是BC;
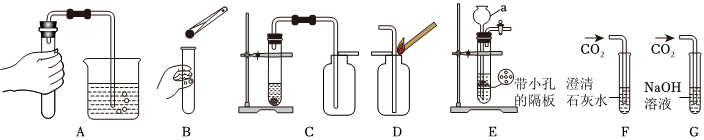
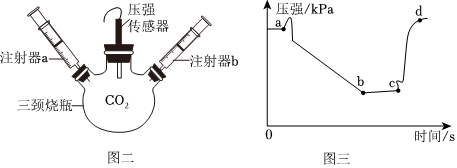
(3)块状大理石和稀硫酸反应生成微溶于水的硫酸钙,硫酸钙会附着在大理石的表面,阻止反应的进一步发生,块状大理石和稀盐酸反应速率始终,粉末状大理石和稀盐酸,由于接触面积大于块状大理石,导致反应速率较快,故实验①对应图3中曲线乙,大理石或石灰石中的碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,该反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
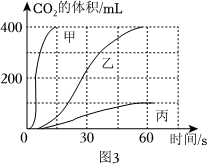
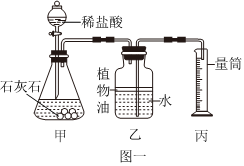
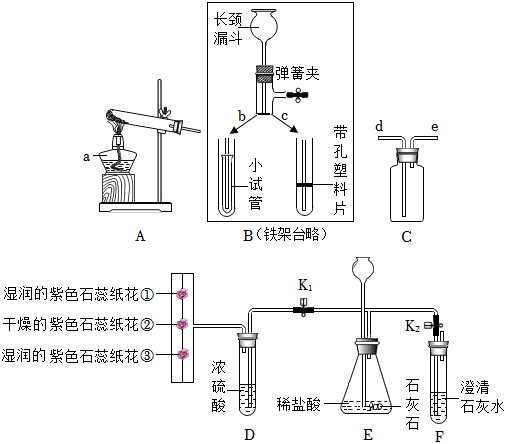
(4)A、进入的气体体积等于排出液体的体积,发生装置中的空气不会影响产生二氧化碳体积的测量,故A符合题意;
B、浓盐酸具有挥发性,挥发出的氯化氢会和碳酸氢钠反应生成氯化钠、水和二氧化碳,使得测量的二氧化碳体积偏大,故B不符合题意;
C、将饱和NaHCO3溶液更换为水,产生的二氧化碳会溶于水,并与水发生反应,使得测量的二氧化碳体积偏小,故C不符合题意;
故选:A。
故答案为:(1)长颈漏斗;
(2)BC;
(3)乙;CaCO3+2HCl=CaCl2+H2O+CO2↑;
(4)A。