[考点]
合金与合金的性质,金属的化学性质,金属锈蚀的条件及其防护,
[答案]
(1)低;
(2)隔绝氧气和水;
(3)BD;
(4)47:18。
[解析]
解:(1)将铜制成黄铜后熔化,则说明合金的熔点比纯铜低。
(2)铁和氧气、水共同接触时会生锈,在铁制品表面涂油漆,能隔绝氧气和水,从而防锈。
(3)由于金属活动性顺序:镁>铁>铜>银,则向含有硝酸银和硝酸镁的废液中加入一定量铁粉与铜粉,铁、铜都不能和硝酸镁反应,铁先和硝酸银反应生成银和硝酸亚铁,待铁完全反应后,铜再与硝酸银反应生成银和硝酸铜,则:
A、若向滤渣中加入稀盐酸,没有气泡生成,则说明滤渣中不含铁,但不能确定其中是否还含有铜,则滤渣中一定含有银,可能含有铜,该选项说法不正确;
B、溶液中含有亚铁离子时显浅绿色,含有铜离子时前蓝色,若滤液为有色溶液,只能说明溶液中一定含有硝酸镁和硝酸亚铁,不能确定其中是否含有硝酸铜和硝酸银,则若含有硝酸银时,一定含有硝酸铜,则滤液中至少有2种金属阳离子,该选项说法正确;
C、硝酸银能和盐酸反应生成氯化银沉淀和硝酸,向滤液中滴加稀盐酸,若产生白色沉淀,则说明硝酸银还有剩余,则滤液中的溶质为硝酸银、硝酸铜、硝酸亚铁和硝酸镁,该选项说法不正确;
D、由Fe+2AgNO3=Fe(NO3)2+2Ag可知,每56份质量的铁能置换出216份质量的银,由Cu+2AgNO3=Cu(NO3)2+2Ag可知,每64份质量的铜能置换出216份质量的银。两个反应中,反应后固体质量均变大,根据质量守恒定律,可知反应后溶液质量均减小,则所得滤液质量一定比原溶液的质量小,该选项说法正确。
(4)根据质量守恒定律,若反应后天平仍平衡,则说明产生氢气的质量应相同,由Zn+H2SO4═ZnSO4+H2↑可知,每65份质量的锌能生成2份质量的氢气;由2Al+3H2SO4═Al2(SO4)3+3H2↑可知,每54份质量的铝能生成6份质量的氢气,即18份质量的铝能生成2份质量的氢气。可见生成等质量的氢气时,消耗的锌和铝的质量比为65:18,而加入的锌粒和铜铝合金质量相同,则铜铝合金中铜、铝的质量比为(65﹣18):18=47:18。
故答案为:(1)低;
(2)隔绝氧气和水;
(3)BD;
(4)47:18。
[点评]
本题考查了"合金与合金的性质,金属的化学性质,金属锈蚀的条件及其防护,",属于"难典题",熟悉题型是解题的关键。
 (1)空易拉罐应放入 (选填可回收物或其它垃圾)筒中。
(1)空易拉罐应放入 (选填可回收物或其它垃圾)筒中。 ?
? 今年九月,西安市开始实施垃圾分类回收。某街道合金内垃圾桶如图所示,请回答下列问题:
今年九月,西安市开始实施垃圾分类回收。某街道合金内垃圾桶如图所示,请回答下列问题: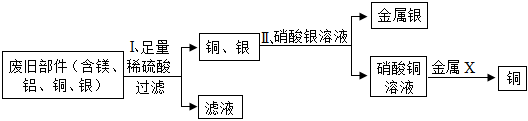

 ?
?
