[考点]
金属活动性的探究,探究金属锈蚀的条件,燃烧的条件与灭火原理探究,
[答案]
(1)燃烧需要与氧气接触;
(2)2、3、4;
(3)Mg>Zn>Fe>Cu;铜;Mg+ZnSO4=MgSO4+Zn;MgSO4、ZnSO4。
[解析]
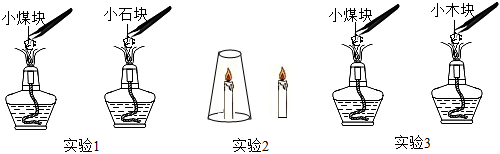
解:(1)实验2中用玻璃杯罩住燃烧的蜡烛,蜡烛燃烧消耗氧气,一段时间后,氧气耗尽,蜡烛熄灭,玻璃杯外的蜡烛与氧气接触,蜡烛燃烧,说明燃烧需要与氧气接触;
(2)实验2中铁钉与氧气和水接触,生锈,实验3中铁钉只与水接触,不生锈,实验4中铁钉只与氧气接触,不生锈,故实验2、3对比,可说明铁生锈需要与氧气接触,实验2、4对比,可说明铁生锈需要与水接触,故能说明铁生锈与氧气和水有关的实验是:2、3、4;
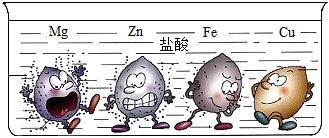
(3)查阅资料:镁与稀盐酸反应,产生气泡,且产生气泡的速率较快,锌与盐酸反应,产生气泡,产生气泡的速率比镁慢,铁与稀盐酸反应,产生气泡,且产生气泡的速率比锌慢,铜与稀盐酸不反应,无明显现象,说明在金属活动性顺序里,镁、锌、铁排在氢前,且镁比锌活泼,锌比铁活泼,铜排在氢后,故四种金属的活动性由强到弱的顺序是:Mg>Zn>Fe>Cu;
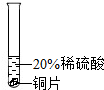
进行实验:实验一:取少量金属材料样品于试管中,加入过量稀硫酸,固体全部溶解,产生气泡,无色溶液变为浅绿色,铁能与稀盐酸反应生成氯化亚铁和氢气,氯化亚铁溶液是浅绿色的,故金属材料中一定含铁,铜与稀盐酸不反应,故一定没有铜;
实验二:步骤2:将打磨过的金属材料浸入过量的硫酸锌溶液中,过一会儿取出,洗净,在一定条件下烘干,称量其质量大于mg,说明该金属材料和硫酸锌发生了反应,故金属材料中一定含镁,镁和硫酸锌反应生成硫酸镁和锌,该反应的化学方程式为:Mg+ZnSO4=MgSO4+Zn,24份质量的镁置换出65份质量的锌,固体质量增加;
由以上分析可知,金属材料为镁和铁,将金属材料浸入过量的硫酸锌溶液中,镁和硫酸锌反应生成硫酸镁和锌,铁和硫酸锌不反应,硫酸锌过量,故废液中溶质的成分是MgSO4、ZnSO4。
故答案为:(1)燃烧需要与氧气接触;
(2)2、3、4;
(3)Mg>Zn>Fe>Cu;铜;Mg+ZnSO4=MgSO4+Zn;MgSO4、ZnSO4。
[点评]
本题考查了"金属活动性的探究,探究金属锈蚀的条件,燃烧的条件与灭火原理探究,",属于"典型题",熟悉题型是解题的关键。



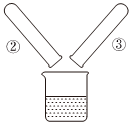
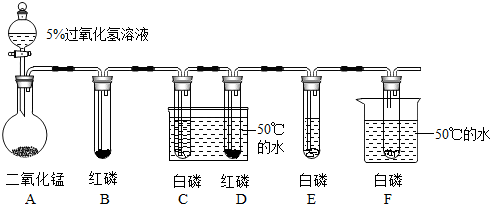
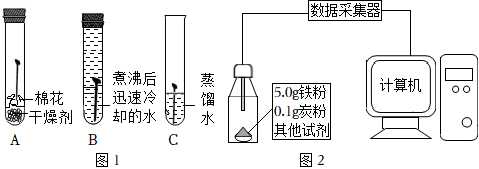
 观察是实验室学习化学的重要方式,以下是初中化学教材必做的学生实验,请回答下列问题:
观察是实验室学习化学的重要方式,以下是初中化学教材必做的学生实验,请回答下列问题: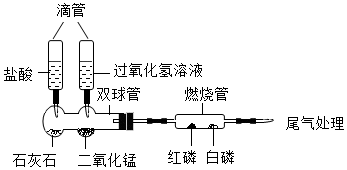
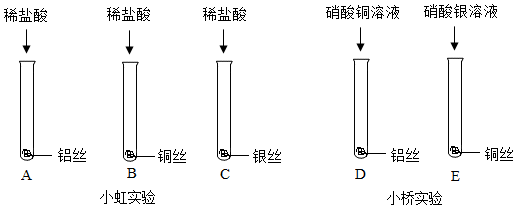
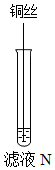
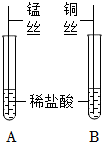
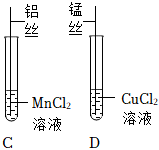
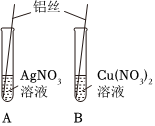 某化学小组用如图所示实验装置,探究铝、铜、银的金属活动性顺序。
某化学小组用如图所示实验装置,探究铝、铜、银的金属活动性顺序。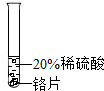

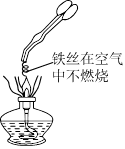
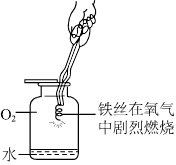
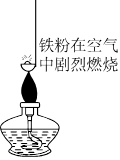
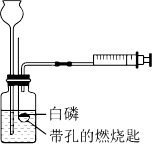
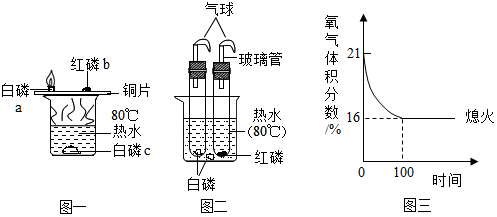
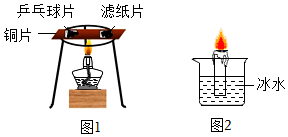
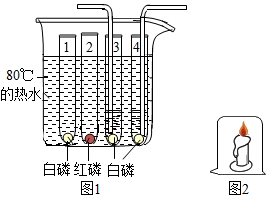 为验证燃烧的三个条件,某化学兴趣小组设计了如下实验,请你一起参加探究。
为验证燃烧的三个条件,某化学兴趣小组设计了如下实验,请你一起参加探究。