[考点]
饱和溶液和不饱和溶液相互转变的方法,晶体和结晶的概念与现象,固体溶解度的概念,固体溶解度曲线及其作用,固体溶解度表格及其作用,
[答案]
(1)45.8;
(2)18;
(3)有未溶解的固体;
(4)AB。
[解析]
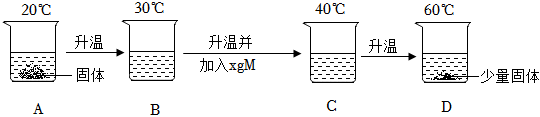
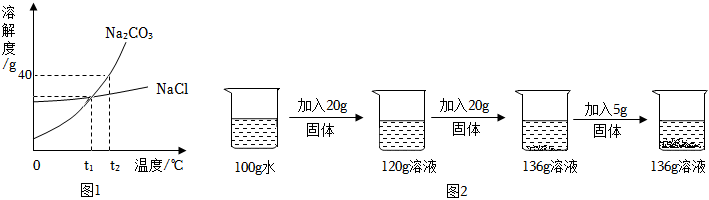
解:(1)由表中内容可知,80℃时,碳酸钠的溶解度是45.8g;
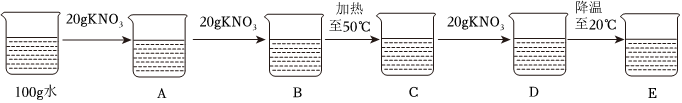
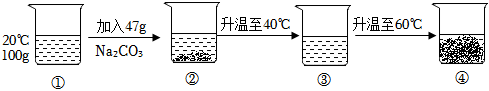
(2)10℃时,碳酸钠的溶解度为12.5g,则225g碳酸钠饱和溶液中溶质的质量为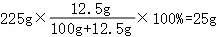 ,其中含有水的质量为225g﹣25g=200g,而20℃时,碳酸钠的溶解度为21.5g,则该温度下200g水中最多可溶解的碳酸钠的质量为21.5g×2=43g,则若想溶液变饱和,需再加入43g﹣25g=18g;
(3)60℃时,碳酸钠的溶解度为46.4g<47g,则烧杯④中有未溶解的固体;
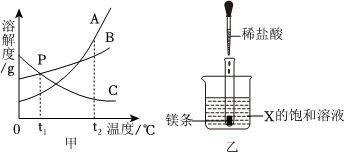
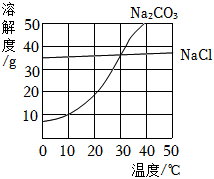
(4)A、40℃时,碳酸钠的溶解度大于氯化钠,则等质量的饱和溶液中,氯化钠的溶液中含溶剂质量较多,降温过程中,溶剂质量不变,则两种溶液中溶剂的质量Na2CO3<NaCl,故正确;
B、30℃时,碳酸钠和氯化钠的溶解度相同,且降温后两种溶液仍为饱和溶液,则两种溶液中溶质质量分数Na2CO3=NaCl,故正确;
C、由图可知,由于碳酸钠的溶解度受温度影响比较大,则降温过程中,析出碳酸钠的质量较大,故错误;
D、降温后,两种溶液中的溶剂质量不同,溶解度相同,则溶质质量也不同,故错误。
故选:AB。
故答案为:(1)45.8;
(2)18;
(3)有未溶解的固体;
(4)AB。
,其中含有水的质量为225g﹣25g=200g,而20℃时,碳酸钠的溶解度为21.5g,则该温度下200g水中最多可溶解的碳酸钠的质量为21.5g×2=43g,则若想溶液变饱和,需再加入43g﹣25g=18g;
(3)60℃时,碳酸钠的溶解度为46.4g<47g,则烧杯④中有未溶解的固体;
(4)A、40℃时,碳酸钠的溶解度大于氯化钠,则等质量的饱和溶液中,氯化钠的溶液中含溶剂质量较多,降温过程中,溶剂质量不变,则两种溶液中溶剂的质量Na2CO3<NaCl,故正确;
B、30℃时,碳酸钠和氯化钠的溶解度相同,且降温后两种溶液仍为饱和溶液,则两种溶液中溶质质量分数Na2CO3=NaCl,故正确;
C、由图可知,由于碳酸钠的溶解度受温度影响比较大,则降温过程中,析出碳酸钠的质量较大,故错误;
D、降温后,两种溶液中的溶剂质量不同,溶解度相同,则溶质质量也不同,故错误。
故选:AB。
故答案为:(1)45.8;
(2)18;
(3)有未溶解的固体;
(4)AB。
[点评]
本题考查了"饱和溶液和不饱和溶液相互转变的方法,晶体和结晶的概念与现象,固体溶解度的概念,固体溶解度曲线及其作用,固体溶解度表格及其作用,",属于"压轴题",熟悉题型是解题的关键。
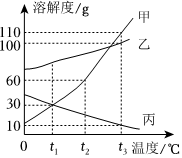
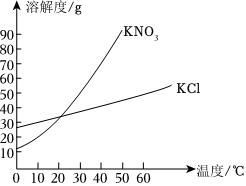
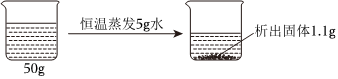

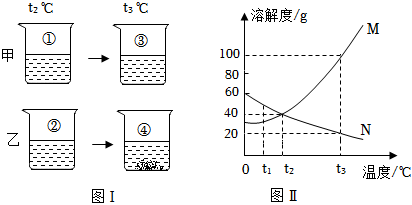
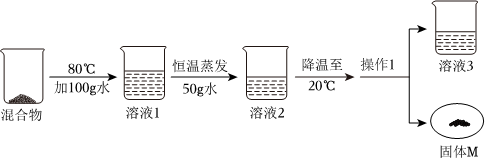

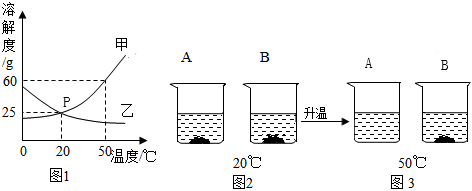
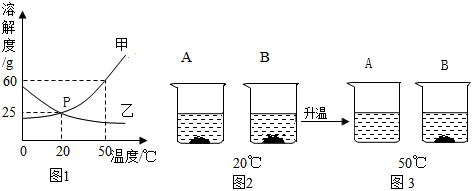
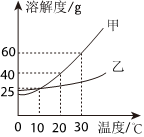 如图是甲、乙两种固体物质的溶解度曲线。据图回答:
如图是甲、乙两种固体物质的溶解度曲线。据图回答: