[考点]
二氧化碳与碱的反应及实验,二氧化碳对环境的影响,质量守恒定律及其应用,
[答案]
(1)化石燃料的大量应用;
(2)丙;Ca(OH)2+CO2=CaCO3↓+H2O;
(3)C2H4。
[解析]
解:(1)由于化石燃料的大量应用产生了大量的二氧化碳,导致大气中二氧化碳含量不断上升等;
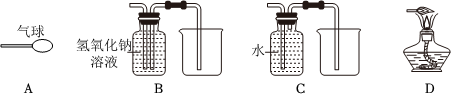
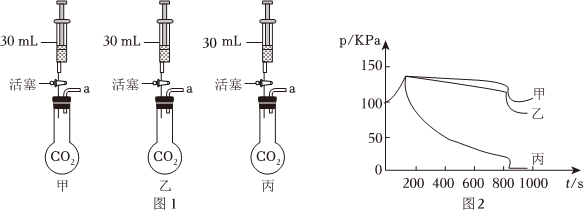
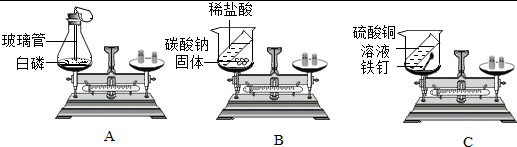
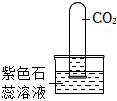
(2)由图2可知,在捕集过程中,使用 NaOH 溶液几乎可将烧瓶内的二氧化碳气体全部吸收,故“捕捉”效果最好的是丙装置;乙中澄清石灰水中的氢氧化钙与二氧化碳反应会生成碳酸钙和水,反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;
(3)由方程式可知,反应前C、H、O的原子个数分别为2、12、4,反应后C、H、O的原子个数分别为0、8、4,根据质量守恒定律化学反应前后原子的种类、个数守恒不变可知,则一个X分子中含有C、H的原子数目是2、4,则其化学式为C2H4。
故答案为:(1)化石燃料的大量应用;
(2)丙;Ca(OH)2+CO2=CaCO3↓+H2O;
(3)C2H4。
[点评]
本题考查了"二氧化碳与碱的反应及实验,二氧化碳对环境的影响,质量守恒定律及其应用,",属于"典型题",熟悉题型是解题的关键。

 ?
?
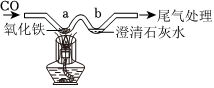
 学习了碳的相关知识后,兴趣小组的同学设计了如图所示的实现碳中和的思路:
学习了碳的相关知识后,兴趣小组的同学设计了如图所示的实现碳中和的思路:
 碳和碳的化合物在自然界中广泛存在。请回答:
碳和碳的化合物在自然界中广泛存在。请回答: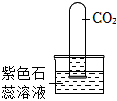 碳和碳的化合物在自然界中广泛存在。请回答:
碳和碳的化合物在自然界中广泛存在。请回答: