服务热线
搜题▪组卷
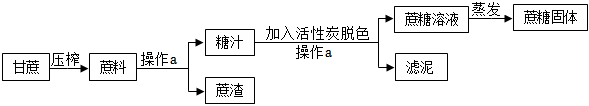 ?
?
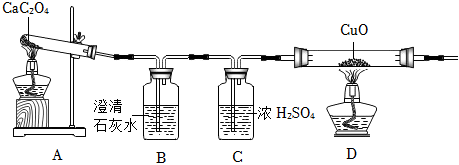
| 实验过程 | 实验现象 | 实验结论 |
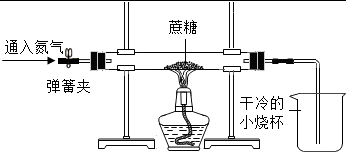
| 小烧杯中加入足量的澄清石灰水,往玻璃管中通入氧气,点燃酒精灯加热 | 玻璃管中黑色固体剧烈燃烧,发出白光,烧杯内 。 | 黑色固体是单质碳 |
| 实验过程 | 实验现象 | 实验结论 |
| 小烧杯中加入足量的澄清石灰水,往玻璃管中通入氧气,点燃酒精灯加热 | 玻璃管中黑色固体剧烈燃烧,发出白光,烧杯内澄清石灰水变浑浊。 | 黑色固体是单质碳 |
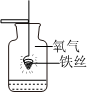
| 实验一:细铁点在氧气中的燃烧 | 实验二:铁与CuSO4溶液反应前后质量的测定 | 铁在高温下和水蒸气反应(图中固定仪影的装置省略了,没有画出) |
 |
 |
 |
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤1:倒出反应后硬质玻璃管中墨色固体C于白纸上,用磁铁反复吸引 | 黑色固体C全部被吸 | 黑色固体C中一定没有FeO,Fe(OH)2,Fe2O3、Fe(OH)3等 |
| 步骤2:取少量反应后的墨色固体C于试管中,加入足量硫酸铜溶液,充分反应。 | 有红色固体出现,且有黑色固体剩余 | 黑色固体C中一定有 和 ,(②③填化学式) |
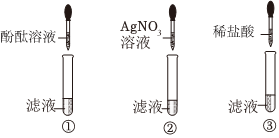
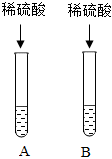 实验课上,同学们以“鉴别氢氧化钠、碳酸钠、稀硫酸、氯化钠”为题展开实验,并探究其反应后混合液的成分。
实验课上,同学们以“鉴别氢氧化钠、碳酸钠、稀硫酸、氯化钠”为题展开实验,并探究其反应后混合液的成分。| 实验步骤 | 实验现象 | 实验结论 | |
| 方案一 | 取少量反应后的液体于试管中,加入适量BaCl2溶液 | 有白色沉淀产生 | 试管A中已发生化学反应 |
| 方案二 | 取少量反应后的液体于试管中,加入几滴酚酞溶液 | 溶液为无色 |
| 实验步骤 | 实验现象 | 实验结论 | |
| 活动— | 取少量烧杯中的溶液于试管中加入足量Ba(NO3)2,再加入少量稀硝酸 | 有白色沉淀产生,加入稀硝酸后, | 溶液中含有Na2CO3,猜想②成立 |
| 活动二 | 取少量烧杯中的溶液于试管中加入稀盐酸 | 有气泡生成 | 溶液中含有Na2CO3,猜想②成立 |
| 活动三 | 加入少量 | 无明显现象 | 溶液中不含H2SO4想④不成立 |
| 序号 | 实验操作 | 实验现象 | 实验结论 |
| ① | 小贾用排水集气法收集A、B两瓶气体,将带火星木条伸入A中;湿润的淀粉碘化钾试纸伸入B中 | A中带火星木条复燃,B中淀粉碘化钾试纸不变色。 | 猜想 成立 |
| ② | 小鹏用排空气法收集C、D两瓶气体,将带火星木条伸入C中,温润的淀粉碘化钾试纸伸入D中 | C带火星木条复燃,D中淀粉碘化钾试纸 。 | 猜想三成立 |
| 温度/℃ | 室温 | 100 | 500 |
| B装置/g | 200.00 | y | 228.00 |
| C装置/g | 100.00 | 100.00 | 103.20 |
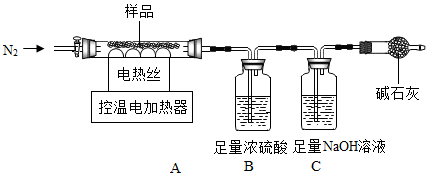
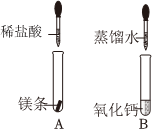 同学们在学习“化学反应中的能量变化”时,进行了如下探究实验。
同学们在学习“化学反应中的能量变化”时,进行了如下探究实验。| 同学 | 实验方案 | 预测实验现象 | 结论 |
| 甲 | 向试管中滴加Na2CO3溶液 | 产生白色沉淀 | 猜想一成立 |
| 乙 | 向试管中通入CO2气体 | 产生白色沉淀 | 猜想二成立 |
| 丙 | 向试管中滴加NaOH溶液 | 产生白色沉淀 | 猜想三成立 |
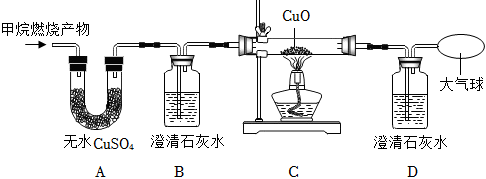
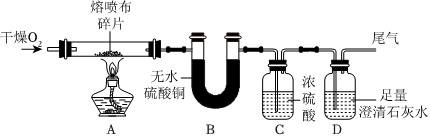
| 实验步骤 | 实验现象 | 实验结论 |
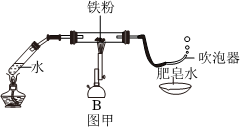
| 将甲烷燃烧的产物依次通过上图装置 | A中无水CuSO4变蓝,B、D中澄清石灰水变浑浊,C中(2) | 猜想四成立 |
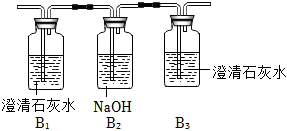
| 编号 | 实验装置及操作 | 实验现象 | 实验结论 |
| 甲 | 在酒精灯上加热该黄色金属片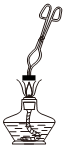 |
黄色金属片变黑 | 该黄色金属片是铜锌合金 |
| 乙 | 将另一份金属片放入试管中,向试管中加入过量硫酸铜溶液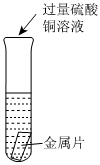 |
| 实验操作 | 实验现象 | 实验结论 |
| 甲同学用排水法收集A、B两瓶气体。将带火星的木条伸入A瓶中,将湿润的淀粉碘化钾试纸伸入B瓶中 | A瓶中带火星的木条复燃。B瓶中湿润的淀粉碘化钾试纸不变色 | 猜想 成立 |
| 乙再学用向上排空气法收集A、B两瓶气体,将带火星的木条伸入A瓶中,将湿润的淀粉碘化钾试纸伸入B瓶中 | A瓶中的现象是带火星的木条复燃,B瓶中的现象是 | 猜想三成立 |
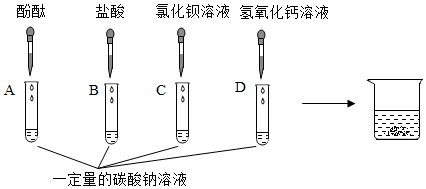
| 实验操作 | 实验现象 | 实验结论 |
| 取大烧杯中上层溶液少许于一支试管中,滴加过量的BaCl2溶液,静置 | ③ ; 试管中的上层溶液仍是红色 |
大烧杯中上层溶液中一定含有CO32-, 发生的化学反应方程式为 ④ ; 同时还能得出大烧杯中的上层溶液中一定含有阴离子是⑤ (填离子符号) |
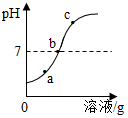 为探究氢氧化钡溶液和稀盐酸反应后所得溶液中溶质的成分,小宇和同学们通过测定了反应过程中溶液的 pH,得到了如图所示曲线,请回答:
为探究氢氧化钡溶液和稀盐酸反应后所得溶液中溶质的成分,小宇和同学们通过测定了反应过程中溶液的 pH,得到了如图所示曲线,请回答:| 实验步骤 | 实验现象 | 实验结论 |
| 另取 b、c 处溶液少量于两支试管中, 分别滴加CuCl2溶液。 |
若 | 该样品为 b 处溶液。 |
| 若 | 该样品为 c 处溶液。 |

wsx@dyw.com
2024-02-04
初中化学 | 九年级上 | 实验题