服务热线
搜题▪组卷
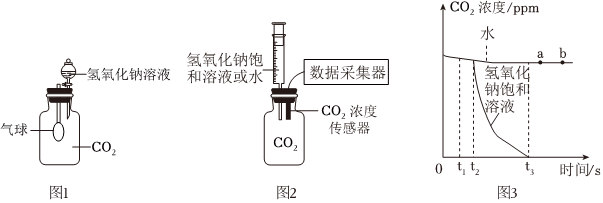
 ?
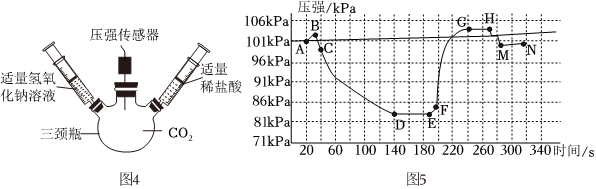
?
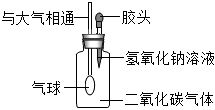
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量B试管反应后的溶液,逐滴加入稀硫酸 | 猜想一正确 |
| 甲同学 | 还可能有Ca(OH)2、NaOH | 乙同学 | 还可能有NaOH、Na2CO3 |
| 丙同学 | 还可能有Ca(OH)2、CaCl2 | 丁同学 | 还可能有Na2CO3 |
| … | … | … | … |
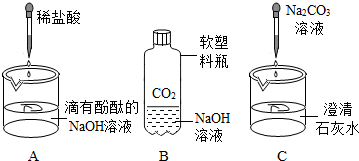
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量滤液于试管中,向其中滴加 | 猜想成立 |
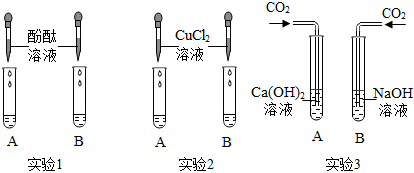
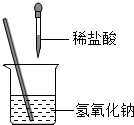 如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向氢氧化钠溶液中滴加稀盐酸,反应一段时间后,发现忘记滴加指示剂。甲同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。
如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向氢氧化钠溶液中滴加稀盐酸,反应一段时间后,发现忘记滴加指示剂。甲同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。| 实验步骤 | 实验现象 | 实验结论 |
| 用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比。 | pH (填“>”、“=”或“<”)7 | 猜想一不成立 |
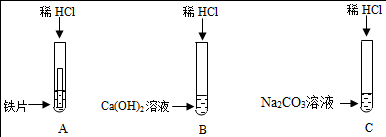
| 实验步骤 | 实验现象 | 实验结论 |
| 猜想三成立 |

bjj@dyw.com
2025-02-17
初中化学 | 九年级上 | 实验题