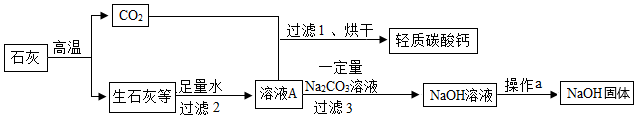
[考点]
金属的化学性质,金属资源现状及保护措施,物质的相互转化和制备,书写化学方程式、文字表达式、电离方程式,
[解析]
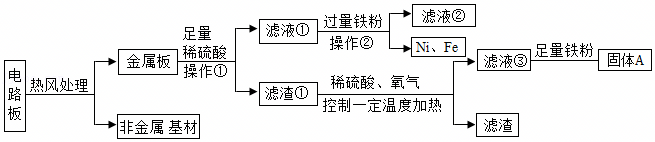
解:金属板加入足量的稀硫酸得到滤渣1和滤液1,滤渣1中加入稀硫酸、氧气控制温度加热,得到银、金、钯和滤液3,滤液3中加入铁粉会生成红色固体A,所以A是铜,滤渣1中含有银、金、钯、铜,滤液3是硫酸铜,滤液4是硫酸亚铁,所以铁、锡、铅、镍排在氢之前,滤液1中加铁得到硫酸亚铁和滤渣2,所以滤渣2中是锡、镍和铅,所以
(1)步骤②中的反应是铁和稀硫酸反应生成硫酸亚铁和氢气,所以基本类型是置换反应;
(2)滤渣2中含有的金属是:Ni、Sn、Pb;
(3)步骤⑤的反应是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=FeSO4+Cu;
(4)金属Ni、Fe、Pd的活动性由强到弱依次是:Fe、Ni、Pd;
(5)除了回收利用废旧金属,节约和保护金属资源的措施还有防止金属的锈蚀。
故答案为:(1)置换;
(2)Ni、Sn、Pb;
(3)Fe+CuSO4=FeSO4+Cu;
(4)Fe、Ni、Pd;
(5)防止金属的锈蚀。
[点评]
本题考查了"金属的化学性质,金属资源现状及保护措施,物质的相互转化和制备,书写化学方程式、文字表达式、电离方程式,",属于"综合题",熟悉题型是解题的关键。
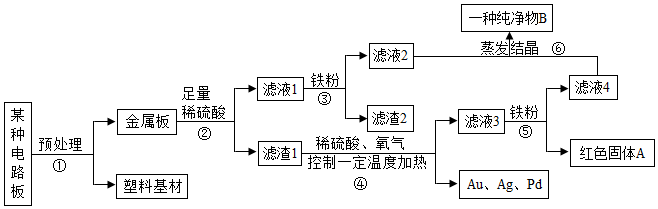
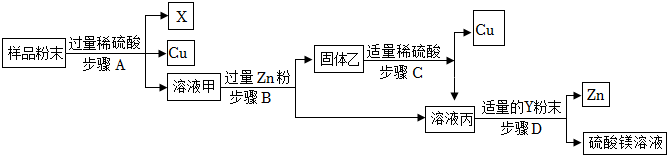
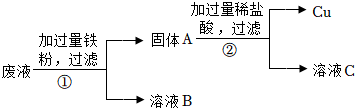 生产线路板的废液中含有FeCl3、FeCl2、CuCl2。化学兴趣小组的同学在实验室利用如图所示流程进行从废液中回收金属铜的实验。(已知:2FeCl3+Fe=3FeCl2)
生产线路板的废液中含有FeCl3、FeCl2、CuCl2。化学兴趣小组的同学在实验室利用如图所示流程进行从废液中回收金属铜的实验。(已知:2FeCl3+Fe=3FeCl2)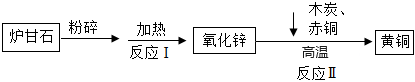

 金属的利用史成就卓越,是劳动人民生产与生活智慧的结晶。
金属的利用史成就卓越,是劳动人民生产与生活智慧的结晶。