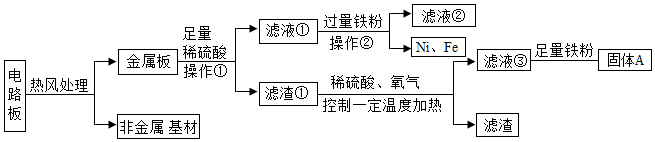
[考点]
金属的化学性质,物质的相互转化和制备,书写化学方程式、文字表达式、电离方程式,
[答案]
(1)四;
(2)有红色固体析出,溶液由蓝色变为无色且有气泡产生;
(3)Mg+ZnSO4=MgSO4+Zn;
(4)Zn(NO3)2、Cu(NO3)2。
[解析]
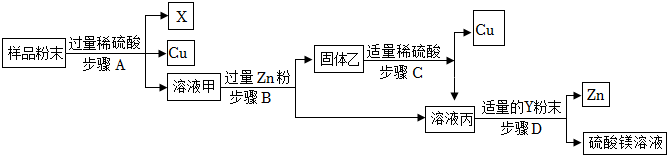
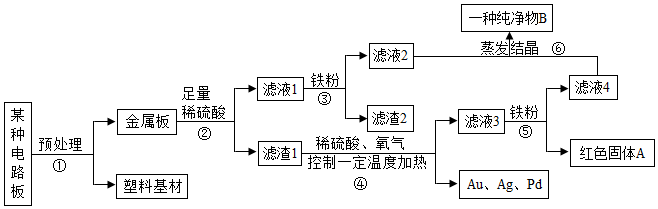
解:(1)镁、氧化铜、锌与硫酸反应分别可以生成硫酸镁,硫酸铜,硫酸锌,溶液甲中的溶质成分有硫酸镁、硫酸铜、硫酸锌和过量的硫酸四种;
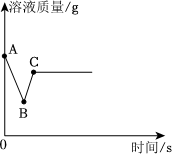
(2)步骤B锌与稀硫酸反应生成硫酸锌和氢气,有气泡产生;锌与硫酸铜反应生成硫酸亚铁和铜,有红色固体析出,溶液由蓝色变为无色,则步骤B反应的实验现象是有红色固体析出,溶液由蓝色变为无色且有气泡产生;
(3)溶液丙中含有硫酸镁、硫酸锌,加入Y粉末后得到锌与硫酸镁,确定Y粉末为镁粉,则步骤D发生的反应为镁与硫酸锌反应生成硫酸镁和锌,反应的化学方程式为Mg+ZnSO4=MgSO4+Zn;
(4)金属活动性:锌>铜>银,根据金属活动性顺序中相距远的先发生反应:先发生的反应:Zn+2AgNO3=Zn(NO3)2+2Ag,后发生的反应:Cu+2AgNO3=Cu(NO3)2+2Ag,
| 不断加入硝酸银溶液 |
发生的反应 |
滤渣成分 |
溶液中溶质成分 |
| ①部分锌反应 |
Zn+2AgNO3=Zn(NO3)2+2Ag |
Ag、Cu、Zn |
Zn(NO3)2 |
| ②全部锌反应 |
Zn+2AgNO3=Zn(NO3)2+2Ag |
Ag、Cu |
Zn(NO3)2 |
| ③部分铜反应 |
Cu+2AgNO3=Cu(NO3)2+2Ag |
Ag、Cu |
Zn(NO3)2、Cu(NO3)2 |
| ④全部铜反应 |
Cu+2AgNO3=Cu(NO3)2+2Ag |
Ag |
Zn(NO3)2、Cu(NO3)2 |
| ⑤硝酸银过量 |
|
Ag |
Zn(NO3)2、Cu(NO3)2、
AgNO3 |
由题干信息充分振荡后过滤,滤液呈蓝色,结合分析可知,③④⑤符合题意,则可推断,滤液中的溶质一定有Zn(NO3)2、Cu(NO3)2,可能含有AgNO3。
故答案为:(1)四;
(2)有红色固体析出,溶液由蓝色变为无色且有气泡产生;
(3)Mg+ZnSO4=MgSO4+Zn;
(4)Zn(NO3)2、Cu(NO3)2。
[点评]
本题考查了"金属的化学性质,物质的相互转化和制备,书写化学方程式、文字表达式、电离方程式,",属于"典型题",熟悉题型是解题的关键。
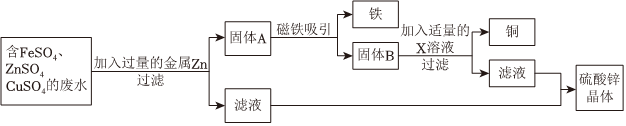
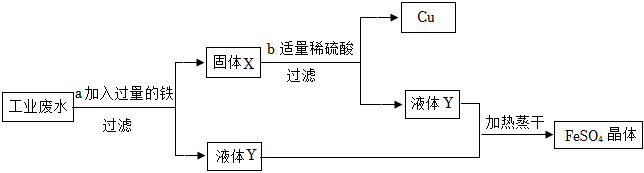
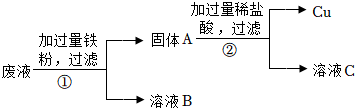 生产线路板的废液中含有FeCl3、FeCl2、CuCl2。化学兴趣小组的同学在实验室利用如图所示流程进行从废液中回收金属铜的实验。(已知:2FeCl3+Fe=3FeCl2)
生产线路板的废液中含有FeCl3、FeCl2、CuCl2。化学兴趣小组的同学在实验室利用如图所示流程进行从废液中回收金属铜的实验。(已知:2FeCl3+Fe=3FeCl2)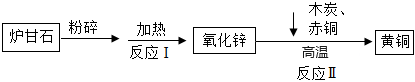
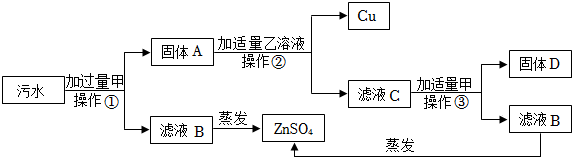

 金属的利用史成就卓越,是劳动人民生产与生活智慧的结晶。
金属的利用史成就卓越,是劳动人民生产与生活智慧的结晶。