[考点]
金属的化学性质,金属活动性顺序及其应用,物质的相互转化和制备,书写化学方程式、文字表达式、电离方程式,
[答案]
(1)活动性;
(2)硫酸(盐酸);铝片表面有致密的氧化膜阻碍了反应的发生;
(3)Zn+2AgNO3=Zn(NO3)2+2Ag;H2SO4。
[解析]
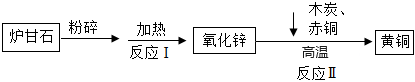
解:(1)由古至今人类大量使用金属的顺序,发现是按金属的活动性由弱到强,同时也决定了金属的冶炼难易程度;
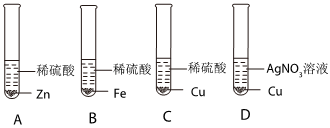
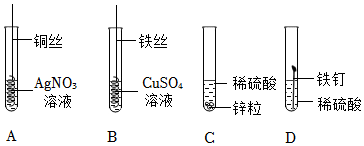
(2)要设计实验方案证明金属的活动性,可以使用与酸混合,观察是否反应以及反应的快慢,表面积大小相同的三种金属片,将它们分别放入相同的硫酸(盐酸)溶液中,观察现象就能比较得出结论;常温下,铝容易与空气中的氧气反应生成致密的氧化膜,如果实验过程中铝片对应的试管没有明显现象,可能是铝片表面有致密的氧化膜阻碍了反应的发生;
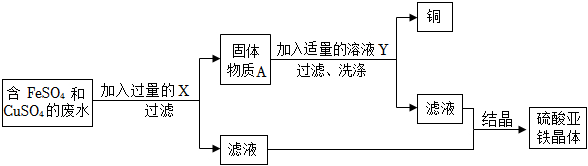
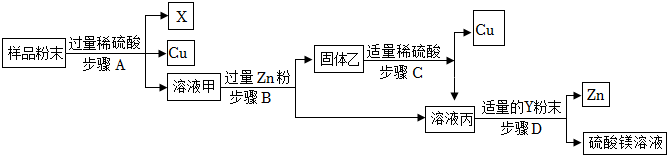
(3)根据流程的目的:对定影液进行处理,回收金属银和硝酸锌固体。锌能和硝酸银反应生成银和硝酸锌,锌能和稀硫酸反应生成氢气和硝酸锌。所以X、Y分别是:Zn;H2SO4;锌能和硝酸银反应生成银和硝酸锌,化学方程式为:Zn+2AgNO3=Zn(NO3)2+2Ag。
故答案为:(1)活动性;
(2)硫酸(盐酸);铝片表面有致密的氧化膜阻碍了反应的发生;
(3)Zn+2AgNO3=Zn(NO3)2+2Ag;H2SO4。
[点评]
本题考查了"金属的化学性质,金属活动性顺序及其应用,物质的相互转化和制备,书写化学方程式、文字表达式、电离方程式,",属于"综合题",熟悉题型是解题的关键。

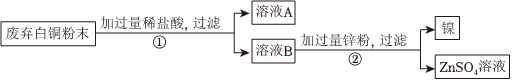
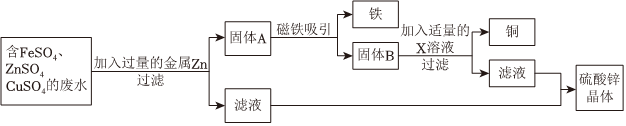
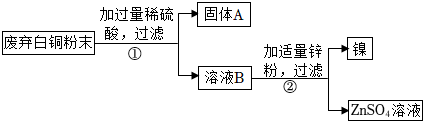
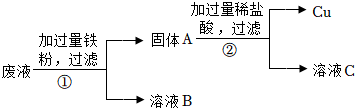 生产线路板的废液中含有FeCl3、FeCl2、CuCl2。化学兴趣小组的同学在实验室利用如图所示流程进行从废液中回收金属铜的实验。(已知:2FeCl3+Fe=3FeCl2)
生产线路板的废液中含有FeCl3、FeCl2、CuCl2。化学兴趣小组的同学在实验室利用如图所示流程进行从废液中回收金属铜的实验。(已知:2FeCl3+Fe=3FeCl2)