[考点]
金属的化学性质,金属活动性顺序及其应用,书写化学方程式、文字表达式、电离方程式,
[答案]
(1)弱;
(2)铜;Zn+NiSO4=ZnSO4+Ni、Zn+H2SO4=ZnSO4+H2↑;
(3)ACD。
[解析]
解:(1)根据题意可知,镍和锌都能与酸反应但是锌与稀硫酸反应更剧烈,说明镍的金属活动性比锌弱;
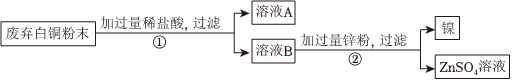
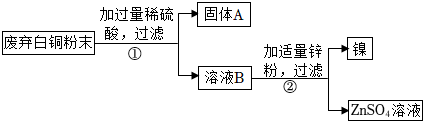
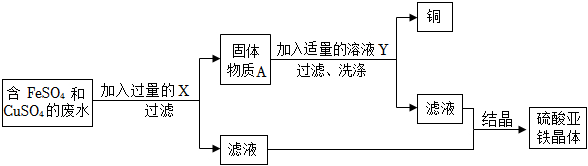
(2)根据资料可知镍能与稀硫酸反应,而铜排在氢后不与酸反应,故此第一步加入的稀硫酸会与镍反应生成硫酸镍和氢气,故固体A是铜;由于酸过量则溶液B中含有硫酸镍和剩余的硫酸,锌会与硫酸反应生成硫酸锌和氢气,由于锌排在镍前,锌能与硫酸镍反应生成硫酸锌和镍,故化学方程式为:Zn+H2SO4=ZnSO4+H2↑、Zn+NiSO4=ZnSO4+Ni。
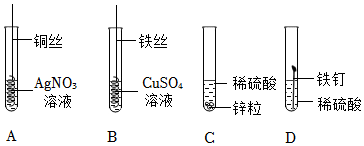
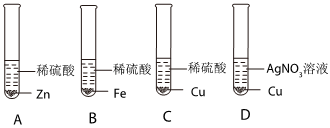
(3)A、镍和锌均能与稀盐酸反应生成氢气产生冒气泡现象,锌粉与稀硫酸反应更剧烈,而铜不能,故此证明铜排在最后,锌在镍前,最终证明锌>镍>铜,选项正确;
B、镍和铜均不能与硫酸锌反应,说明锌的活动性最强,但无法证明镍和铜的活动性,选项错误;
C、锌能与硫酸镍反应置换出镍说明锌在镍前,而铜不与硫酸镍反应无现象,说明铜在镍后,最终证明锌>镍>铜,选项正确;
D、镍不能与硫酸锌反应说明锌在镍前,镍能与硫酸铜反应有红色物质析出,说明镍在铜前,最终证明锌>镍>铜,选项正确;
故选:ACD。
故答案为:(1)弱;
(2)铜;Zn+NiSO4=ZnSO4+Ni、Zn+H2SO4=ZnSO4+H2↑;
(3)ACD。
[点评]
本题考查了"金属的化学性质,金属活动性顺序及其应用,书写化学方程式、文字表达式、电离方程式,",属于"典型题",熟悉题型是解题的关键。