服务热线
搜题▪组卷
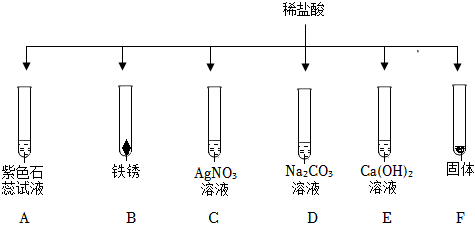
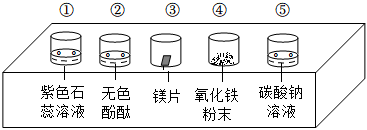
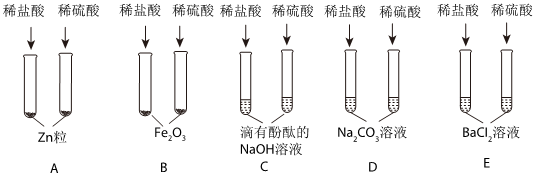
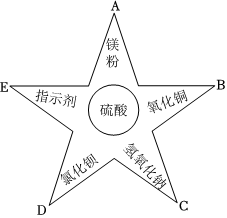 小乐同学复习酸的化学性质时,构建了硫酸的“五角星图”,其中五个顶角表示能与硫酸发生化学反应的五类物质。
小乐同学复习酸的化学性质时,构建了硫酸的“五角星图”,其中五个顶角表示能与硫酸发生化学反应的五类物质。| 实验 | 实验现象 |
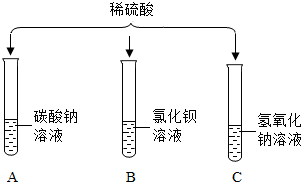
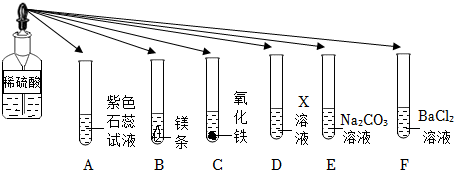
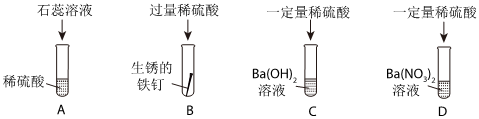
| 步骤1:将试管A中物质全部倒入试管D中 | 产生气泡且白色沉淀增加 |
| 步骤2:过滤,得到滤液 | |
| 步骤3:向滤液中逐滴滴加氢氧化钠溶液 | 开始无明显现象,一段时间后出现白色沉淀 |
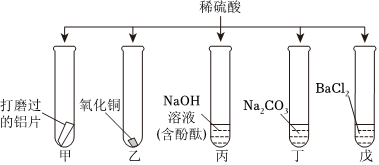
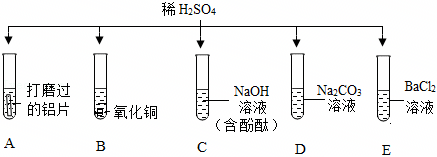
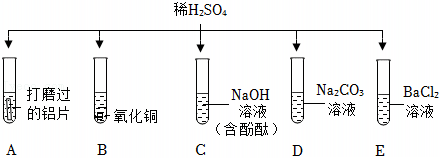
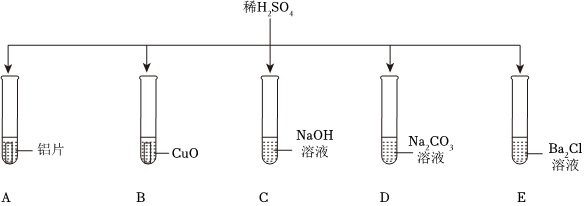
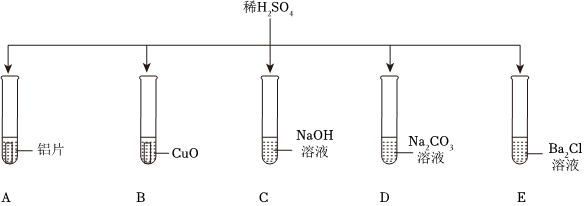
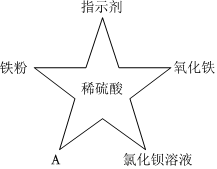 五星红旗闪耀奥运赛场,小王同学复习酸的化学性质时构建了硫酸“五角星图”,其中五个顶角表示与硫酸发生化学反应的五种不同类别的物质。
五星红旗闪耀奥运赛场,小王同学复习酸的化学性质时构建了硫酸“五角星图”,其中五个顶角表示与硫酸发生化学反应的五种不同类别的物质。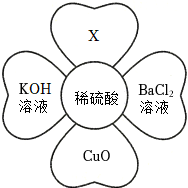 如图所示,稀硫酸能与相连的物质发生化学反应。
如图所示,稀硫酸能与相连的物质发生化学反应。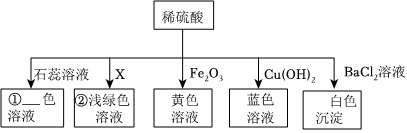

dm@dyw.com
2025-03-30
初中化学 | | 填空题