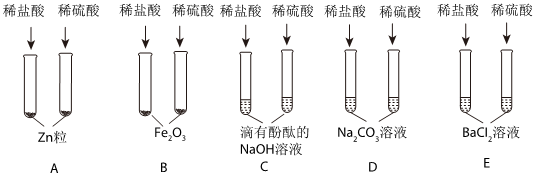
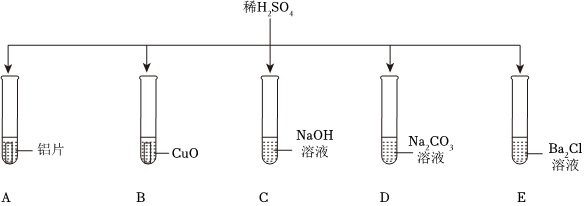
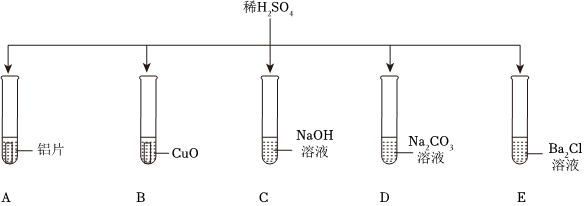
[解析]
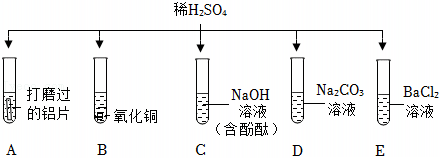
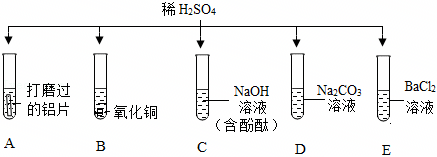
解:(1)A试管中稀硫酸与铝反应生成硫酸铝和气氢气,产生气泡;B试管中稀硫酸与氧化铜反应生成硫酸铜和水,不生成气体,无气泡生成;C试管中稀硫酸与氢氧化钠反应生成硫酸钠和水,观察到红色溶液褪色,不产生气泡;D试管中稀硫酸与碳酸钠反应生成硫酸钠、水和二氧化碳,有气泡产生;E试管中稀硫酸与氯化钡反应生成硫酸钡沉淀和盐酸,无气泡产生;
(2)由图可知,试管B中的反应是稀硫酸与氧化铜反应生成硫酸铜和水,故反应的化学方程式为:H2SO4+CuO=CuSO4+H2O。
(3)稀硫酸与氯化钡反应生成硫酸钡沉淀和稀盐酸,所以将试管E中的浊液过滤后,滤液中一定含有稀盐酸,方案一加入锌粒后,锌与稀盐酸和稀硫酸均能够反应生成氢气产生气泡,无法判断滤液中是否含有稀硫酸。
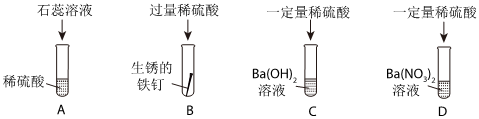
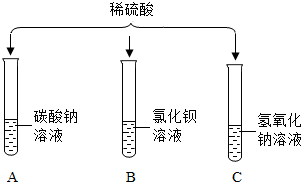
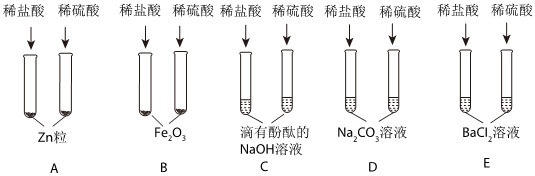
A、硝酸银与稀盐酸反应生成氯化银的白色沉淀,硝酸银与稀硫酸反应生成硫酸银,硫酸银微溶于水,如果生成的硫酸银较多,不能溶解的硫酸银也以沉淀的形式存在,无法判断稀硫酸的存在情况,故A错误;
B、氯化钡与稀硫酸反应生成硫酸钡的白色沉淀,可以说明稀硫酸的存在,故B正确;
C、碳酸氢钠与稀盐酸和稀硫酸均能够反应生成二氧化碳气体而产生气泡,现象相同,无法说明稀硫酸的存在情况,故C错误;
D、金属铝与稀盐酸和稀硫酸均能反应生成氢气,产生气泡,现象相同,无法说明稀硫酸的存在情况,故D错误;
故选:B。
故答案为:(1)AD;
(2)H2SO4+CuO=CuSO4+H2O;
(3)B。
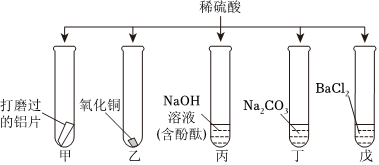
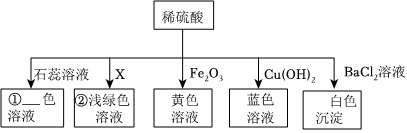
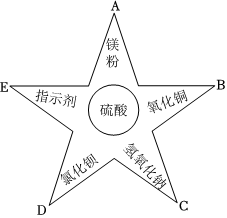 小乐同学复习酸的化学性质时,构建了硫酸的“五角星图”,其中五个顶角表示能与硫酸发生化学反应的五类物质。
小乐同学复习酸的化学性质时,构建了硫酸的“五角星图”,其中五个顶角表示能与硫酸发生化学反应的五类物质。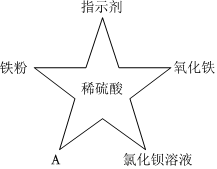 五星红旗闪耀奥运赛场,小王同学复习酸的化学性质时构建了硫酸“五角星图”,其中五个顶角表示与硫酸发生化学反应的五种不同类别的物质。
五星红旗闪耀奥运赛场,小王同学复习酸的化学性质时构建了硫酸“五角星图”,其中五个顶角表示与硫酸发生化学反应的五种不同类别的物质。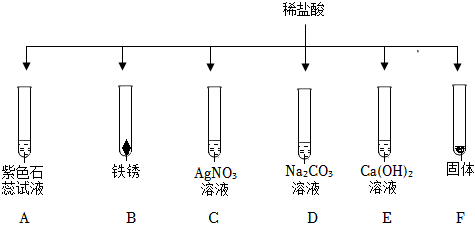
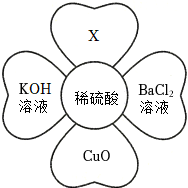 如图所示,稀硫酸能与相连的物质发生化学反应。
如图所示,稀硫酸能与相连的物质发生化学反应。